© Blender / CDC (Dr. V. R. Dowell, Jr.) / Sandy Westermann
News • Mehfachzucker-Verwertung
Mikrobiom-Forschung: Neue Erkenntnisse zum Stoffwechsel der Darmmikrobiota
Für die menschliche Gesundheit spielt der Darm eine zentrale Rolle. Die Zusammensetzung der Mikrobiota und ihre Funktionen für das Wohlbefinden des Menschen hängen stark davon ab, wie gut sich die Bakterien an die ständigen Veränderungen im Darmmilieu anpassen.
Die Frage, wie Darmkommensalen ihren Stoffwechsel auf tägliche Schwankungen des Nahrstoffangebots einstellen, ist daher zu einem zentralen Thema der Mikrobiota-Forschung geworden.
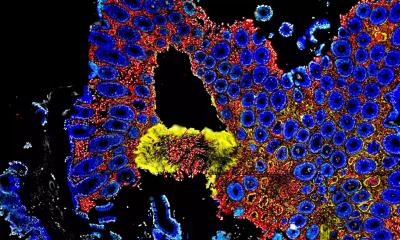
Obwohl sich das mikrobielle Ökosystem des Darms von Mensch zu Mensch unterscheidet, gibt es einige häufige Arten. Dazu zählt Bacteroides thetaiotaomicron. Diese Mikroben verfügen über Dutzende verschiedene Multiprotein-Komplexe, die auf spezifischen Stellen im Genom kodiert sind – den sogenannten PULs (von engl. polysaccharide utilization loci). Die Komplexe können spezifische Mehrfachzucker binden, spalten sowie importieren und tragen somit zur erfolgreichen Besiedlung des Darms bei. Die Bildung dieser PUL-Komplexe wird dabei streng auf Ebene der Transkription kontrolliert, wobei die Information der DNA in Boten-RNA (mRNA, von engl. messenger ribonucleic acid) umgeschrieben wird. Wie PULs auf posttranskriptioneller Ebene reguliert werden, um auf Umweltveränderungen zu reagieren, ist dagegen bisher weitgehend unerforscht. Hier haben Wissenschaftler des Würzburger Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI), einem Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) in Kooperation mit der Julius-Maximilians-Universität Würzburg (JMU), sowie des Lehrstuhls für Mikrobiologie an der JMU angesetzt. In Zusammenarbeit mit der Vanderbilt University in Nashville (Tennessee, USA) und der University of Toronto in Kanada führten sie eine Reihe von In-vitro- und In-vivo-Experimenten durch.
„Unsere Ergebnisse deuten auf ein bemerkenswert komplexes RNA-basiertes Netzwerk hin, das die PUL-Expression in B. thetaiotaomicron steuert“, erläutert der korrespondierende Autor Alexander Westermann die Forschungsergebnisse der Studie, die im Fachmagazin Nature Communications erschienen ist. „Damit ergänzen wir frühere Arbeiten, die sich auf transkriptionelle Kontrollmechanismen konzentrierten“, schließt er an.
Unsere Ergebnisse bieten einen vielversprechenden Ansatz, dieses mikrobielle Konsortium besser zu verstehen und für neue Behandlungsstrategien nutzbar zu machen
Alexander Westermann
Im Zentrum dieses Netzwerks steht das RNA-Bindeprotein RbpB: „Wir haben herausgefunden, dass das Fehlen von RbpB die Darmbesiedlung deutlich beeinträchtigt“, sagt Ann-Sophie Rüttiger, Erstautorin der Studie und Doktorandin im Labor von Alexander Westermann.
Die funktionelle Analyse zeigte, dass RbpB mit Hunderten von zellulären Transkripten interagiert. Dazu gehört eine Gruppe verwandter nicht-kodierender RNA-Moleküle (FopS, von engl. family of paralogous sRNAs) mit 14 Mitgliedern. Gemeinsam steuern RbpB und FopS Prozesse zur Energiegewinnung und sorgen so dafür, dass die Mikroben optimal auf wechselnde Bedingungen reagieren können. „Diese Studie erweitert unser Verständnis der RNA-koordinierten Stoffwechselkontrolle, die für die Überlebenschancen dominanter Mikrobiota-Spezies entscheidend ist“, so Rüttiger.
Künftige Studien sollen die Struktur von RbpB genauer untersuchen und die Schlüsselmechanismen der RNA-Bindung identifizieren. Das Team plant zudem, die funktionelle Ähnlichkeit von RbpB mit anderen RNA-bindenden Proteinen zu analysieren, um zentrale posttranskriptionelle Steuerungspunkte in der Darmmikrobiota zu entschlüsseln.
Ein vertieftes Wissen über die bakteriellen Gen- und Proteinfunktionen könnte maßgeblich dazu beitragen, neue therapeutische Ansätze zur Bekämpfung von Infektions- und Darmerkrankungen sowie zur Gesundheitsförderung durch gezielte Beeinflussung der Darmmikrobiota zu entwickeln. „Unsere Ergebnisse bieten einen vielversprechenden Ansatz, dieses mikrobielle Konsortium besser zu verstehen und für neue Behandlungsstrategien nutzbar zu machen“, fasst Westermann zusammen.
Quelle: Helmholtz Zentrum für Infektionsforschung
09.01.2025