
Quelle: Jonas Koeppel
News • Neuer Wirkmechanismus
Kleines Molekül vernichtet Krebstreiber
Die sogenannten "molekularen Kleber" bezeichnen eine neue Klasse von potenziellen Krebsmedikamenten. Sie verbinden ein wachstumsförderndes Protein mit dem Entsorgungssystem der Zelle, sodass der Krebstreiber beseitigt werden kann. Wissenschaftler aus Heidelberg und den USA haben nun einen weiteren Mechanismus eines solchen "molekularen Klebers" entschlüsselt.
Das neuartige Wirkstoffmolekül bindet hierbei an das Protein BCL6, das bei der Entstehung von Lymphdrüsenkrebs eine entscheidende Rolle spielt. Bevor das Protein durch das Entsorgungssystem der Zelle abgebaut wird, verklebt die neue Substanz BCL6-Moleküle zu langen Ketten. Die Forschungsergebnisse eröffnen neue Wege in der Wirkstoffentwicklung für die Behandlung von Krebs.
Die meisten klinisch eingesetzten zielgerichteten Krebsmedikamente sind kleine Moleküle, die die Aktivität von wachstumsfördernden Proteinen hemmen. In den letzten Jahren wurden zahlreiche solcher krebstreibenden Proteine identifiziert. Von allen bekannten Krebstreibern bieten aber nur wenige geeignete Angriffspunkte für diese Wirkstoffe. Eine zentrale Herausforderung für die Krebsforschung ist daher die Suche nach neuen Wirkstoffgruppen. Eine ganz neue Klasse dieser Medikamente sind die sogenannten "molekularen Kleber". Sie induzieren Wechselwirkungen zwischen einem Protein und Komponenten des zellulären Systems, das nicht benötigte oder krebstreibende Zellbestandteile entsorgt. Das bekannteste Medikament dieser Art ist Lenalidomid, das in Deutschland für die Behandlung bestimmter Blutkrebsarten, darunter das multiple Myelom und das myelodysplastische Syndrom, zugelassen ist.
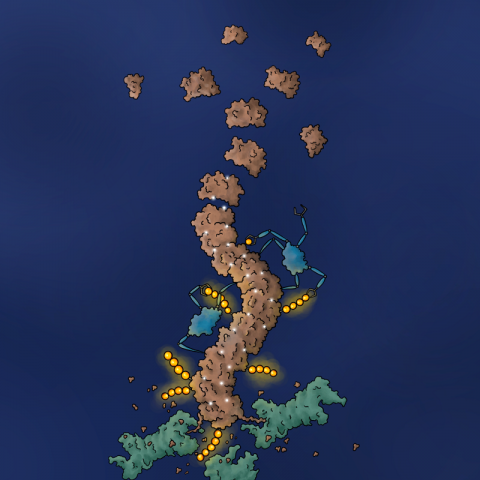
Forscher des Deutschen Krebsforschungszentrums (DKFZ), am Nationalen Centrum für Tumorerkrankungen (NCT) Heidelberg, des Broad Institute vom MIT und der Harvard Universität in Cambridge sowie dem Dana-Farber Cancer Institute in Boston haben nun einen weiteren Mechanismus eines Wirkstoffmoleküls aus der Gruppe der "molekularen Kleber" aufgedeckt. Das Protein, das hierbei mit dem Entsorgungsystem der Zelle verbunden wird, trägt den Namen BCL6. Das vermehrte Auftreten von BCL6 in einer Zelle begünstigt die Entwicklung einer bestimmten Form von Lymphdrüsenkrebs. Das macht BCL6 zu einem geeigneten Kandidaten für zielgerichtete Medikamente. Auf der Suche nach einem BCL6-Hemmer hat das pharmazeutische Unternehmen Boehringer Ingelheim ein kleines Molekül identifiziert, das an einen spezifischen Teil von BCL6 bindet und den Abbau von BCL6 induziert, sodass Lymphomzellen in Laborexperimenten absterben.
"Um herauszufinden, was mit BCL6 nach der Behandlung mit dem kleinen Wirkstoffmolekül geschieht, haben wir BCL6 durch eine Markierung sichtbar gemacht und beobachtet, wie das Protein unter dem Mikroskop innerhalb weniger Minuten abgebaut wurde und verschwand," erklärt Jonas Koeppel, einer der Erstautoren der Studie. "Diese Beobachtungen deuteten auf einen Arzneimittelmechanismus hin, der Wechselwirkungen mit BCL6 in der Zelle auslöst," ergänzt Mitautorin Lena Nitsch.
"Dies ist die erste Studie, die zeigt, wie ein kleines Molekül krebsauslösende Proteine inaktivieren kann."
Mikołaj Słabicki
Eine entscheidende Entdeckung bei der Aufklärung des Mechanismus war die Tatsache, dass BCL6 bei der Behandlung mit der neuen Substanz lange Fasern bildete. Forschungsarbeiten unter der Leitung von Hojong Yoon, Doktorand an der Harvard Medical School und am Dana-Farber Cancer Institute, konnten die molekulare Struktur dieser Fasern mit einer elektronenmikroskopischen Technik entschlüsseln. Sie erkannten, dass der Wirkstoff an eine Art Rille auf dem BCL6-Molekül bindet und anschließend eine Wechselwirkung mit einem zweiten, benachbarten BCL6-Protein auslöst. Auf diese Weise "klebt" das neuartige Wirkstoffmolekül einzelne BCL6-Moleküle zusammen. Man spricht hierbei von einer Polymerisation.
"Dies ist die erste Studie, die zeigt, wie ein kleines Molekül krebsauslösende Proteine inaktivieren kann, indem es eine Polymerisation und die anschließende Entsorgung durch die Zelle induziert," sagt Mikołaj Słabicki, Erstautor der Studie. "Unser Ziel ist es, noch mehr solcher kleinen Moleküle zu identifizieren, die über einen ähnlichen Mechanismus arbeiten und krebstreibende Proteine unterschiedlicher Krebsarten vernichten können."
"Ich bin sehr stolz darauf, dass es jungen Wissenschaftlern unserer Abteilung - Mikołaj Słabicki, Jonas Koeppel und Lena Nitsch - gelungen ist, eine solch fundamentale Entdeckung zu machen, und ich freue mich, Teil dieser transatlantischen Zusammenarbeit zu sein," sagt Stefan Fröhling, Leiter der Abteilung Translationale Medizinische Onkologie am DKFZ, Geschäftsführender Direktor des NCT Heidelberg und Mitautor der Studie.
Quelle: NCT Heidelberg
27.11.2020





