© Charité/BIFOLD
News • Neue Methode zur Risikoabschätzung
KI verbessert Lungenkrebs-Diagnostik
Forschungsteam aus Berlin und München entwickelt neue Methode zur Risikoabschätzung
Ein interdisziplinäres Forschungsteam von BIFOLD (Berlin Institute for the Foundations of Learning and Data), der Technischen Universität Berlin, dem Universitätsklinikum Köln, der Charité – Universitätsmedizin Berlin, dem KI-Unternehmen Aignostics und der Ludwig-Maximilians-Universität München (LMU) hat eine neuartige, KI-gestützte Methode entwickelt, um präzisere Prognosen für Lungenkrebspatienten treffen zu können. Die Studie wurde jetzt in der Fachzeitschrift Nature Communications veröffentlicht.
Unsere Ergebnisse zeigen, dass multimodale, erklärbare KI Einblicke in die klinische Relevanz biomedizinischer Daten ermöglichen kann, die mit konventionellen Verfahren nicht zu erreichen sind
Klaus-Robert Müller
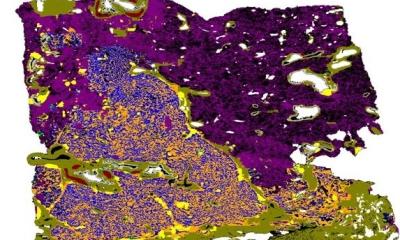
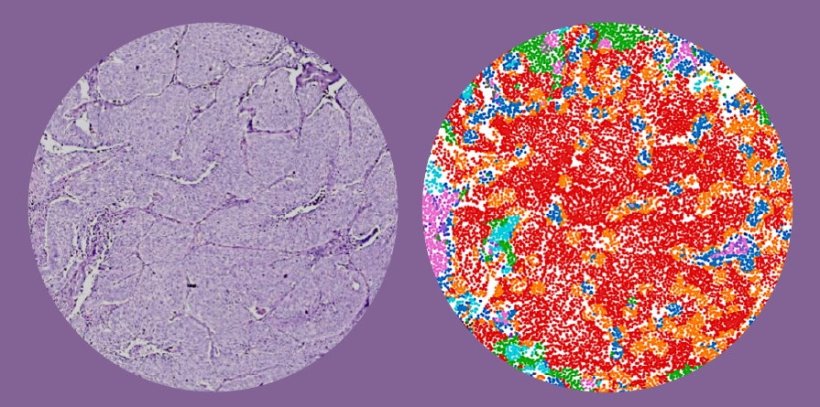
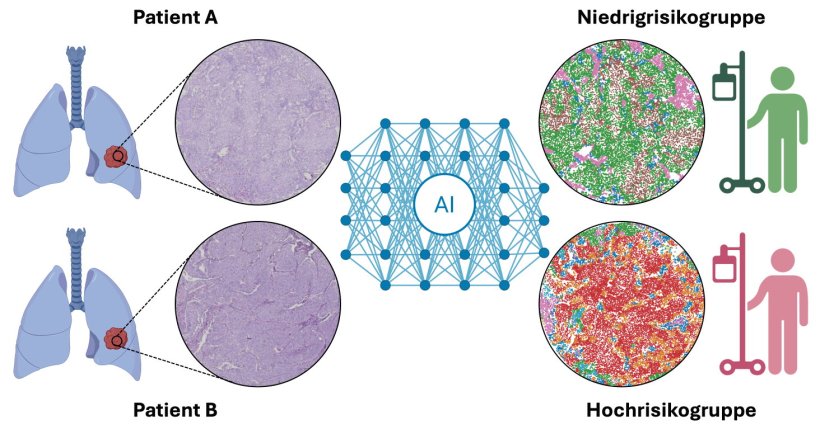
Das interdisziplinäre Forschungsteam hat ein neues Verfahren entwickelt, um die Wahrscheinlichkeit für Rezidive bei Lungenkrebs besser abzuschätzen. Bisher ist dies anhand von Merkmalen wie Tumorgröße oder Lymphknotenbefall insbesondere in frühen Krankheitsstadien nur unzureichend möglich. Das sogenannte „Staging“ erfasst jedoch nicht die detaillierte Interaktion des Tumors mit den verschiedenen Zelltypen des Immunsystems und Bindegewebes in seiner Umgebung. In ihrer Arbeit kombinieren die Forschenden histologische Daten, Multiplex-Immunfluoreszenz-Bildgebung und multimodales maschinelles Lernen, um die komplexen zellulären Strukturen und Wechselwirkungen in der Tumorumgebung von 1168 Patienten aus zwei großen deutschen Krebszentren zu analysieren.
Dabei konnten die Wissenschaftler 43 verschiedene Zelltypen und deren räumliche Beziehung im Tumormikromilieu charakterisieren und sogenannte zelluläre Nischen identifizieren. Das sind kleine „Nachbarschaften“ von Zellen (Radius ca. 34 µm), in denen jeweils die Zusammensetzung der Zelltypen (Tumorzellen, T- und B-Lymphozyten, Makrophagen etc.) analysiert wurde. Durch die KI-gestützte Kombination dieser Muster mit etablierten klinischen Parametern gelang eine deutliche Verbesserung der Risikostratifizierung. "KI hilft uns, die räumliche Zellorganisation und die Bildung spezifischer Zellnischen im Tumor besser zu verstehen und dieses Wissen in klinisch relevante Entscheidungen zu übersetzen“, sagt PD Dr. Simon Schallenberg, Pathologe an der Charité und einer der Erstautoren der Studie.
© Charité/BIFOLD
„Diese Nischenmuster liefern prognostisch relevante Informationen zusätzlich zum klassischen Staging. Wir konnten zeigen, dass die Zusammensetzung der Zellen im Tumorumfeld eng mit dem Überleben der Patienten zusammenhängt, insbesondere bei frühen Lungenkrebsstadien“, erklärt Prof. Dr. Frederick Klauschen, Forschungsgruppenleiter am BIFOLD und Pathologe an der LMU München. „Viele dieser Betroffenen können allein durch eine Operation erfolgreich behandelt werden, aber nicht alle. Unsere Methode hilft nun, jene mit höherem Rückfallrisiko zu erkennen, die von einer ergänzenden Therapie profitieren könnten.“
„Unsere Ergebnisse zeigen, dass multimodale, erklärbare KI Einblicke in die klinische Relevanz biomedizinischer Daten ermöglichen kann, die mit konventionellen Verfahren nicht zu erreichen sind. Das Verfahren kombiniert KI-gestützte Bildanalyse mit KI-basierten Vorhersagemodellen, ist automatisiert und soll in prospektiven Studien weiter validiert werden“, erklärt Prof. Dr. Klaus-Robert Müller, BIFOLD/TU Berlin.
Diese Forschung verdeutlicht, wie künstliche Intelligenz und moderne Bildgebung gemeinsam neuartige Einblicke in die Tumorbiologie ermöglichen – und damit die Grundlage für präzisere Diagnostik und personalisierte Therapie-Entscheidungen schaffen.
Quelle: Technische Universität Berlin
17.11.2025