© RUB, Marquard
News • Protein-Diagnostik
KI und Infrarot-Mikroskopie klassifizieren Darmkrebs
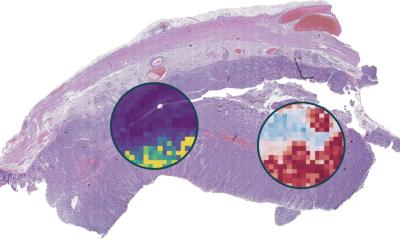
Innerhalb von nur 30 Minuten kann die Infrarotmikroskopie automatisiert erkennen, um welche Form von Darmtumor es sich handelt. Auf dieser Basis lassen sich Therapieentscheidungen sicherer treffen.
Ein Forschungsteam des Zentrums für Proteindiagnostik Prodi der Ruhr-Universität Bochum (RUB) hat auf Quanten-Kaskaden-Lasern basierte Infrarot (IR)-Mikroskope eingesetzt, um Gewebeproben von Dickdarmkrebs aus dem klinischen Alltag markerfrei und automatisiert zu klassifizieren. Dabei gelang es mithilfe künstlicher Intelligenz binnen rund 30 Minuten, mit großer Treffsicherheit verschiedene Tumortypen zu unterscheiden. Die Klassifizierung ist die Grundlage einer Prognose des Krankheitsverlaufs und der Wahl einer Therapie. Das Team berichtet in der Zeitschrift Scientific Reports.
Bildquelle: Kallenbach-Thieltges et al., Scientific Reports 2020 (CC BY 4.0)
Bei Dickdarm- und anderen Krebserkrankungen unterscheidet man zwischen mikrosatellitenstabilen (MSS) und mikrosatelliteninstabilen (MSI) Tumoren. Mikrosatelliten sind meist funktionslose, kurze DNA-Sequenzen, die sich häufig wiederholen. Patienten mit MSI-Tumoren haben eine deutlich höhere Überlebensrate. Der Grund liegt in einer rund 1.000-fach erhöhten Mutationsrate der Krebszellen, die ihr Wachstum weniger erfolgreich macht. Weiterhin ist bei Patienten mit MSI-Tumoren die innovative Immuntherapie erfolgreicher. „Es ist also für die Prognose und die Entscheidung für eine Therapie wichtig zu wissen, um welche Art des Tumors es sich handelt“, so Prof. Dr. Anke Reinacher-Schick, Leiterin der Abteilung für Hämatologie und Onkologie des RUB-Klinikums St. Josef-Hospital. Bisher erfolgt die differentielle Diagnose durch immunhistochemische Färbungen von Gewebeproben mit anschließender aufwändiger Genanalyse.
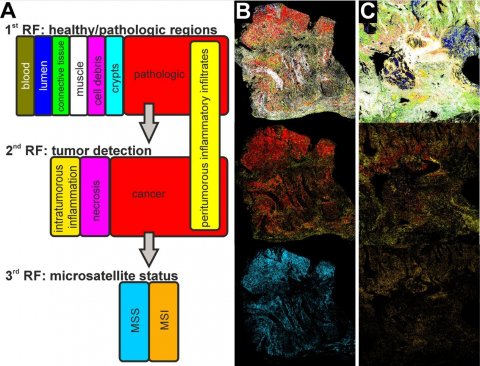
Das Potenzial des IR-Imaging als diagnostisches Werkzeug zur Klassifizierung von Gewebe, die sogenannte Label-freie digitale Pathologie, hatte die Gruppe um Prof. Dr. Klaus Gerwert vom RUB-Lehrstuhl für Biophysik schon in früheren Studien gezeigt. Das Verfahren erkennt Krebsgewebe ohne vorherige Färbung oder andere Markierung und funktioniert daher auch automatisiert mithilfe künstlicher Intelligenz. Im Gegensatz zur herkömmlichen differentiellen Diagnose des Mikrosatellitenstatus, der etwa einen Tag dauert, benötigt das neue Verfahren dafür nur etwa eine halbe Stunde.
Die entscheidende Verbesserung des Verfahrens liegt darin, dass das Team der Proteinforschung es auf die Erkennung einer molekularen Veränderung des Gewebes erweitert hat. Zuvor waren nur morphologische Visualisierungen des Gewebes möglich. „Dies ist ein großer Schritt, der zeigt, dass das IR-Imaging eine vielversprechende Methodik in der zukünftigen Diagnostik und Therapieprädiktion werden kann“, so Klaus Gerwert.
In Zusammenarbeit mit dem Institut für Pathologie der RUB unter Leitung von Prof. Dr. Andrea Tannapfel und der Abteilung für Hämatologie und Onkologie des RUB-Klinikums St. Josef-Hospital führte das Forschungsteam eine Machbarkeitsstudie mit 100 Patienten durch. Sie zeigte eine Sensitivität von 100 Prozent und eine Spezifität von 93 Prozent: Alle MSI-Tumoren wurden mit dem neuen Verfahren korrekt klassifiziert, wenige wurden fälschlich als MSI-Tumoren erkannt. Nun startet eine erweiterte klinische Studie, die an Proben aus der Colopredict-Plus-2.0-Registerstudie durchgeführt wird. Die Registerstudie wurde von Andrea Tannapfel und Anke Reinacher-Schick initiiert und erlaubt die Validierung der Ergebnisse der veröffentlichten Arbeit. „Interessant ist die Methodik auch, weil sehr wenig Probenmaterial verbraucht wird, was in der heutigen Diagnostik mit immer mehr anwendbaren Techniken ein entscheidender Vorteil sein kann“, so Andrea Tannapfel.
Künftig soll das Verfahren in den klinischen Workflow eingebracht werden, um herauszufinden, wie groß sein Potenzial für die Präzisionsonkologie ist. „Eine schnelle und präzise Diagnostik ist aufgrund der immer gezielteren Therapie bei onkologischen Erkrankungen von großer Bedeutung“, erklärt Anke Reinacher-Schick.
Quelle: Ruhr-Universität Bochum (RUB)
23.06.2020