Quelle: Michael Potente, MDC
News • Angiogenese
Grund für Wachstum von Blutgefäßen entdeckt
Blutgefäße müssen ihr Wachstum an das in ihrer Umgebung vorhandene Nährstoffangebot anpassen, um Organe bedarfsgerecht zu versorgen. Forschende des Max-Delbrück-Centrums für Molekulare Medizin und des Berlin Institutes of Health in der Charité haben zwei Proteine beschrieben, die eine wichtige Rolle in diesem Prozess spielen.
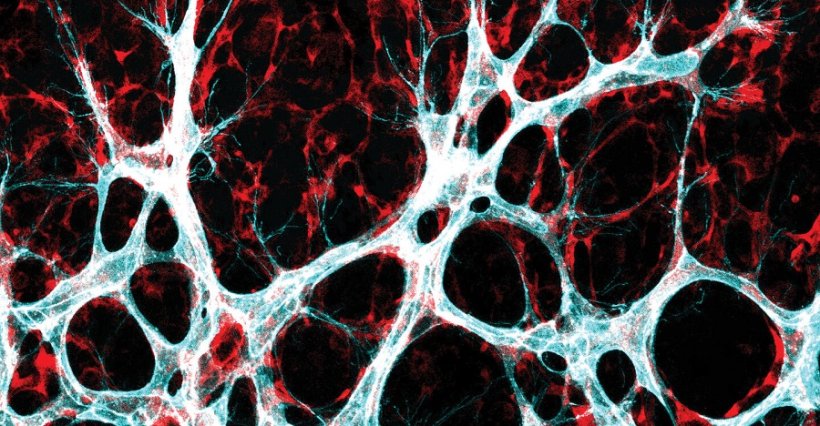
Blutgefäße durchziehen den gesamten menschlichen Körper. Sie stellen sicher, dass Organen ausreichend Nährstoffe und Sauerstoff zur Verfügung stehen. Funktionieren diese feinmaschigen Netzwerke nicht mehr so, wie sie sollen, drohen Krankheiten. Während sie zum Beispiel bei altersabhängigen Herz-Kreislauf-Leiden häufig verkümmern, sind bösartige Tumore durch ein überschießendes Wachstum fehlgeleiteter Gefäße gekennzeichnet. Auch bei der feuchten Makuladegeneration des Auges sprießen neue Blutgefäße – allerdings nicht dort, wo sie es sollen. Dies kann im schlimmsten Fall zu Blindheit führen.
Zwei Türöffner für Nährstoffe
„Um für solche Erkrankungen maßgeschneiderte Therapien entwickeln zu können, wollen wir herausfinden, wie genau das Wachstum neuer Blutgefäße, die Angiogenese, im Körper gesteuert wird“, sagt Michael Potente, Professor für Translationale Vaskuläre Biomedizin am Berlin Institute of Health in der Charité (BIH) und Gastforscher am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC).
Gemeinsam mit einem internationalen Team hat Potente jetzt einen wichtigen Schritt getan: Wie die Forschenden berichten, sind zwei Proteine namens YAP und TAZ entscheidend dafür, dass auch unter schwierigen Stoffwechselbedingungen Gefäße aussprießen können. Die Proteine gehören zum Hippo-Signalweg, der in fast allen Lebewesen das Wachstum und die Größe von Organen bestimmt. „Sind die beiden Moleküle in den Zellen der Gefäßinnenwand – dem Endothel – aktiv, so werden Gene abgelesen, die zur vermehrten Bildung bestimmter Oberflächentransporter führen“, erläutert Potente. „Diese ermöglichen es den Gefäßzellen, vermehrt Nährstoffe aufzunehmen, die für Wachstum und Zellteilung erforderlich sind.“ Die in ihrer Funktionsweise ähnlichen Proteine YAP und TAZ fungieren damit als eine Art Türöffner.
„Die gesteigerte Nährstoffaufnahme wiederum ermöglicht die Aktivierung eines weiteren Proteins, das mTOR genannt wird“, sagt Potente. mTOR ist eine zentrale Schaltstelle in Zellen, die Wachstum und Zellteilung in Gang setzt. „Auf diese Weise können neue Gefäßnetzwerke expandieren“, erklärt der Forscher. Welche Signale die Aktivität von YAP und TAZ in Endothelzellen bestimmen, wissen er und sein Team bislang allerdings noch nicht.
Einsichten aus der Netzhaut
Erstautorin der Studie ist Dr. Yu Ting Ong vom Max-Planck-Institut für Herz- und Lungenforschung im hessischen Bad Nauheim, an dem Potente bis zu seinem Wechsel nach Berlin eine Arbeitsgruppe geleitet hat. Auch Professor Holger Gerhardt, Leiter der MDC-Arbeitsgruppe „Integrative Vaskuläre Biologie“ und Potentes Nachbar im Käthe-Beutler-Haus in Berlin-Buch, war an der Publikation beteiligt. „Wir haben gemeinsam einen wichtigen Mechanismus entschlüsselt, der es Blutgefäßen ermöglicht, ihr Wachstumsverhalten eng an die Umgebungsbedingungen anzupassen“, sagt Gerhardt. „Er verhindert, dass Endothelzellen sich teilen, wenn die dafür notwendigen Stoffwechselressourcen nicht vorhanden sind.“
Die Ergebnisse basieren auf Experimenten an Mäusen. Deren Netzhaut ist ein ideales Modell, um die Entwicklung von Blutgefäßen zu untersuchen. „Mithilfe genetisch veränderter Mauslinien konnten wir zeigen, dass Endothelzellen, in denen die Proteine YAP und TAZ nicht hergestellt werden, sich kaum teilen“, berichtet Potente. „Dies führte bei den Tieren zu einer Hemmung des Gefäßwachstum.“ Das Protein TAZ spielt bei dem Prozess eine besonders wichtige Rolle – anders als bei den meisten Zelltypen, in denen YAP entscheidend ist.
Eine bedeutsame molekulare Maschinerie
„Da neue Blutgefäße häufig in mangeldurchbluteten Geweben entstehen, müssen Endothelzellen in der Lage sein, unter schwierigsten Stoffwechselbedingungen zu wachsen“, sagt Potente. „Daher ist es für diese Zellen von besonderer Bedeutung, eine molekulare Maschinerie zu besitzen, die subtile Veränderungen im extrazellulären Milieu wahrnimmt und auf diese reagiert.“
Gemeinsam mit ihren Teams wollen Potente und Gerhardt nun untersuchen, inwieweit der von ihnen während der Gewebeentwicklung beschriebene Mechanismus auch in Regenerations- und Reparaturprozesse involviert ist, bei denen Blutgefäße eine essentielle Rolle spielen. „In erster Linie sind wir daran interessiert, herauszufinden, ob und – wenn ja – auf welche Weise Störungen des beschriebenen Signalwegs beim Menschen Gefäßkrankheiten bedingen“, sagt Potente.
Die Forschungsergebnisse wurden in „Nature Metabolism“ veröffentlicht.
Quelle: Max-Delbrück-Centrum für Molekulare Medizin und Berlin Institute of Health in der Charité
22.06.2022