Bildquelle: Adobe Stock/kkolosov
News • Genetisch kodierte Nano-Barcodes
Nano-Reporter-Proteine sollen unsichtbare Prozesse sichtbar machen
Wie kommunizieren die Nervenzellen unseres Gehirns miteinander? Welche Prozesse laufen ab, wenn eine T-Zelle eine Krebszelle unschädlich macht? Noch immer sind die Details der Mechanismen auf zellulärer Ebene für uns unsichtbar.
Spezielle Reporter-Proteine, die ein Forschungsteam unter Leitung der Technischen Universität München (TUM) entwickelt hat, sollen dabei helfen, diese sichtbar zu machen. Die Forscher veröffentlichten ihre Erkenntnisse in der Fachzeitschrift Nature Biotechnology unter den Titeln "Genetically encoded barcodes for correlative volume electron microscopy" und "Augmenting electron microscopy with barcoded gene reporters".
Ein Blick durch das Elektronenmikroskop ermöglicht Wissenschaftlern den bisher tiefsten Blick in zelluläre Strukturen – seine Auflösung liegt im Sub-Nanometerbereich. Sogar Zellbestandteile wie Mitochondrien oder Verknüpfungen zwischen Nervenzellen sind zu erkennen. Trotzdem bleiben wichtige Strukturen und Prozesse unsichtbar. „Das ist etwa so, als würde man einen Blick auf eine Stadtkarte werfen“, erklärt Gil Gregor Westmeyer, Professor für Neurobiological Engineering an der TUM und Direktor des Instituts für Synthetische Biomedizin bei Helmholtz Munich. „Diese ist ausreichend, um einen visuellen Eindruck der Umgebung zu bekommen und zu sehen, wo die Straßen verlaufen. Wie oft die Ampeln geschaltet werden, wie viel Verkehr wann an welchen Stellen herrscht oder wo gerade etwas umgebaut wird, ist daraus aber nicht ersichtlich.“
Um aber in Prozesse, die fehlerhaft sind, eingreifen zu können, oder diese in künstlichen Geweben und Organen nachzubauen, ist ein Verständnis über die Vorgänge innerhalb und zwischen den Zellen zwingend notwendig. Westmeyer und seine Kolleg:innen haben daher ein sogenanntes genetisches Reporter-System entwickelt, das für sie in den Zellen sozusagen Aufklärungsarbeit leistet. Bei den Gen-Reportern handelt es sich um Proteinkapseln, die gerade groß genug sind, dass sie im Elektronenmikroskop erkannt werden können.
Identifikation durch Barcodes
Produziert werden die Kapseln von den Zellen selbst. Ihre genetische Bauanleitung wird an bestimmte Zielgene angeheftet. Sind die Zielgene aktiv, werden die Reporter-Proteine hergestellt. Das grundlegende Prinzip dieser Methode ist in der Lichtmikroskopie bereits Standard. Hier arbeiten Forschende mit fluoreszierenden Proteinen. Diese Methode ist für das Elektronenmikroskop aber nicht geeignet, da hier keine Farben, sondern unterschiedliche Formen anhand zum Beispiel ihrer Elektronendichten unterschieden werden.
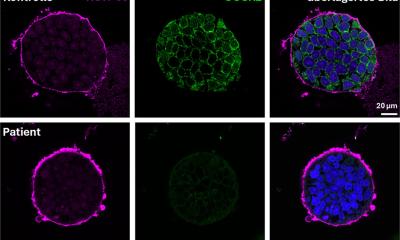
Dies haben die Wissenschaftler ausgenutzt, in dem sie in unterschiedlich große Kapseln metallbindende Proteine eingebaut haben. Diese „EMcapsuline“ erscheinen dann als konzentrische Kreise unterschiedlicher Größe unter dem Elektronenmikroskop und können wie Barcodes mit Künstlicher Intelligenz schnell gefunden und zugeordnet werden.
Unsichtbare Strukturen werden erkennbar
Wenn wir den EMcapsulinen außerdem noch fluoreszierende Eigenschaften verleihen, ist es möglich, die Strukturen zunächst in der Lichtmikroskopie im lebenden Gewebe zu untersuchen.
Felix Sigmund
Was genau können die Forschenden nun mithilfe der Reporter-Proteine herausfinden? Sie können zum einen eingesetzt werden, um die Aktivität bestimmter Gene anzuzeigen; aber auch, um Strukturen zu finden, die im Elektronenmikroskop sonst nicht sichtbar wären – wie etwa elektrische Synapsen zwischen Nervenzellen oder Rezeptoren, die die Interaktion zwischen Krebszellen und T-Zellen beeinflussen.
„Wenn wir den EMcapsulinen außerdem noch fluoreszierende Eigenschaften verleihen, ist es möglich, die Strukturen zunächst in der Lichtmikroskopie im lebenden Gewebe zu untersuchen“, sagt Felix Sigmund, Erstautor der Studie. Dabei könnten auffällige Dynamiken oder Strukturen beobachtet werden, die in einem nächsten Schritt im Elektronenmikroskop hochaufgelöst werden.
„Es ist auch möglich, die Reporter-Proteine in Zukunft als Sensoren einzusetzen, die ihre Struktur ändern, zum Beispiel wenn eine Zelle aktiv wird. So lassen sich die Zusammenhänge zwischen Zellfunktion und Struktur besser aufklären, was auch für das Verständnis von Krankheitsprozessen relevant ist, sowie für die Herstellung von therapeutischen Zellen und Geweben“, ergänzt Westmeyer.
Dazu werden die Forscher auch die neue Elektronenmikroskopie Facility der TUM nutzen und mit dem neuen TUM Center for Organoid Systems (COS) zusammenarbeiten.
Quelle: Technische Universität München (TUM)
19.04.2023