Bildquelle: Medizinische Universität Innsbruck/Univ.-Klinik für Neuroradiologie
News • Deep Learning und Hirnscans
Frühchen-MRT mit KI optimieren
Ein Team an der Univ.-Klinik für Radiologie (interim. Direktorin: Elke Gizewski) hat gemeinsam mit der Mathematikerin Nadja Gruber (Universität Innsbruck) einen Algorithmus entwickelt, der erstmals 3D-Bilddaten von Gehirnuntersuchungen bei Frühgeborenen automatisiert analysieren kann. Nun gilt es, die Künstliche Intelligenz weiter zu trainieren.
Nun gilt es, die Künstliche Intelligenz weiter zu trainieren. Die Wissenschaftler stellen ihre Arbeit im Fachjournal 'Artificial intelligence in Medicine' vor.
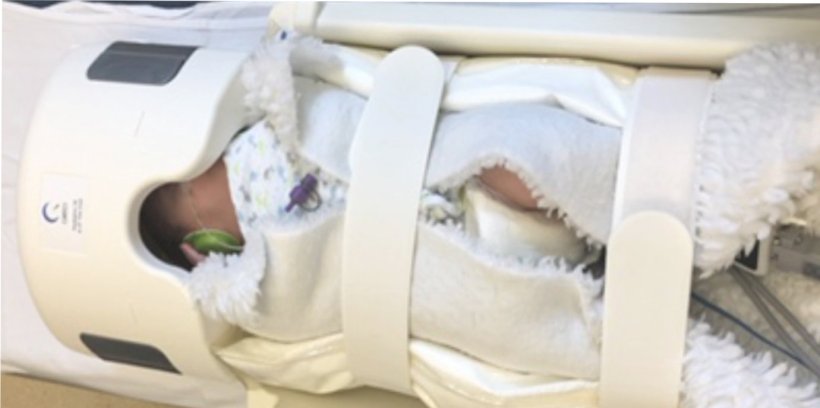
Wenn Frühgeborene auf die Welt gebracht werden, erhalten sie am Tag des errechneten Geburtstermins eine Magnetresonanztomografie (MRT). Anhand der Bildgebung können einerseits akute Notfälle wie große Blutungen ausgeschlossen und anderseits strukturelle Auffälligkeiten des Gehirns frühzeitig erkannt werden. Dies wiederum ist wichtig, um die weitere klinische Betreuung planen und mögliche Förderschienen legen zu können. „Inzwischen wissen wir, dass auch in den feineren Strukturen des Gehirns Reifungsverzögerungen auftreten können, die wir uns zum Beispiel mittels MR-Spektroskopie anschauen. Bei dieser Untersuchung können wir die Hirnsubstanz quantitativ analysieren und beispielsweise den Anteil der Nervenmarker oder des Stützmaterials bestimmen. Mit weiteren bildgebenden Methoden sehen wir auch die Verbindungsfasern für die motorische Funktion, die ebenfalls wichtig für die Entwicklung sind“, schildert Elke Gizewski, interim. Direktorin der Univ.-Klinik für Radiologie und Direktorin der Univ.-Klinik für Neuroradiologie. Bisher werden all diese Untersuchungen allerdings händisch von Radiologen ausgewertet. Das ist zeitaufwändig und kann aufgrund der subjektiven Einschätzung auch zu Fehlern führen.
Insgesamt braucht es mindestens 200 Datensätze, um einen Algorithmus einzulernen, zu validieren und zu analysieren
Elke Gizewski
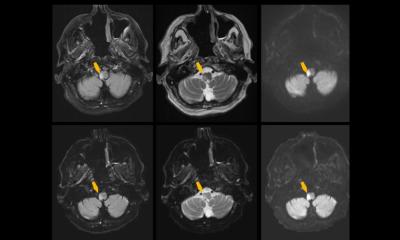
Künftig soll sich das ändern: Forscher an der Klinik beschäftigen sich intensiv damit, ein Netzwerk zu trainieren, das sie mithilfe von Künstlicher Intelligenz geschaffen haben, und das die entsprechenden Hirnanteile selbstständig und objektiv auswerten soll. Wesentlichen Anteil an diesem Projekt hat die Mathematikerin Nadja Gruber, die im Rahmen einer Kooperation von Universität Innsbruck und Medizinischer Universität Innsbruck derzeit ihr PhD-Studium an der Angewandten Mathematik der Leopold-Franzens-Universität Innsbruck und der Univ.-Klinik für Radiologie absolviert. Sie hat den entsprechenden Algorithmus entwickelt und ist Erstautorin der neuen Studie. „Wir haben unseren Algorithmus mit zwei Vorarbeiten verglichen und gesehen, dass er deutlich überlegen ist. Wir sind die ersten, die drei verschiedene Ebenen der segmentierten Gehirnteile – die sagittale, die axiale und die koronale – angeschaut und als 3D-Datensatz in das Netzwerk eingepflegt haben. Das ist sehr komplex“, schildert Gizewski. Insgesamt hat ihr Team rund ein Jahr an der Entwicklung des Projekts gearbeitet. Malik Galijasevic und Tanja Janjic haben dabei die aufwändige Aufgabe übernommen, die ersten Datensätze per Hand genauestens zu segmentieren und in das Netzwerk einzupflegen. „Insgesamt braucht es mindestens 200 Datensätze, um einen Algorithmus einzulernen, zu validieren und zu analysieren. Wir wenden das Prinzip des supervised learnings an. Einfach erklärt bedeutet das, dass wir der Künstlichen Intelligenz anfangs zeigen, wo sie schauen muss, damit sie in der Folge daraus lernen kann“, sagt Gizewski.
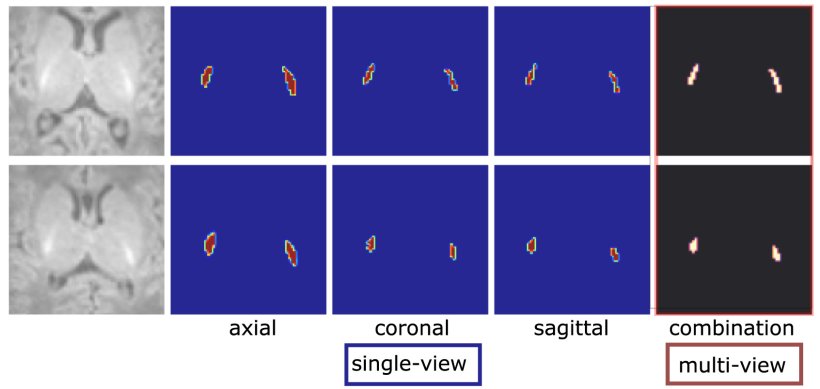
Bildquelle: Gruber et al., Artificial Intelligence in Medicine 2023 (CC BY 4.0)
Nun gelte es, die Künstliche Intelligenz mit Datensätzen aus großen Kohorten weiter zu trainieren, so dass diese in der Lage ist, selbstständige Auswertungen vorzunehmen und damit zu objektiven Ergebnissen zu gelangen. Dafür können eigene klinische Bilddaten herangezogen und in Zusammenarbeit mit der Univ.-Klinik für Pädiatrie II (Neonatologie, Direktorin: Ursula Kiechl-Kohlendorfer) definiert werden. Ebenso stehen Bilddatensätze des Human Genome Project zur Verfügung.
Der Core Facility für neurowissenschaftliche Bildgebungsforschung steht ein 3-Tesla-MRT nur für die Forschung zur Verfügung. „Die Aussagekraft der Magnetresonanztomografie bei Frühgeborenen ist am besten, wenn diese gleich am Tag des errechneten Geburtstermins durchgeführt wird. Frühgeburtlichkeit ist sehr häufig und, je früher die Babys geboren werden, desto häufiger treten Reifungsverzögerungen auf. Doch nicht bei allen verläuft die Entwicklung gleich. Daher ist die Abschätzung mittels Bildgebung sehr hilfreich“, erklärt die Klinikdirektorin. Neugeborene werden nach dem Füttern, wenn sie schlafen im MRT untersucht. Sie erhalten einen eigens für sie konzipierten Gehörschutz und benötigen keine Narkose während des Vorgangs.
Unter der Leitung der Medizinischen Universität Innsbruck laufen an der Univ.-Klinik für Radiologie laufen im Rahmen des geförderten doc.funds Programms „Image Guided Diagnosis und Therapy – Integrating Multimodal Strategies for Clinical Research“ derzeit mehrere Kooperationsprojekte mit der Universität Innsbruck und der UMIT. In diesen Projekten befassen sich die Forscher mit Künstlicher Intelligenz in Zusammenhang mit Bildgebungsdaten, Analyse und Intervention (Zielsteuerung).
Quelle: Medizinische Universität Innsbruck; Text: T. Mair
24.03.2023