Die Blitzabwehr der Bakterien
Bringen Bakterien in den Körper eines Menschen oder eines Tieres ein, werden sie vom Immunsystem als fremd erkannt. Daraufhin versuchen die Immunzellen, diese Fremdkörper zu beseitigen. Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig haben nun gemeinsam mit Kollegen der Universität Umeå in Schweden herausgefunden, wie es Bakterien der Gattung Yersinia schaffen, Immunzellen direkt beim ersten Kontakt abzutöten: Sie vervielfältigen die genetische Information für ihre krankmachenden Werkzeuge und schießen gleichzeitig Substanzen in die Immunzelle, die sie schnell inaktivieren und umbringen.
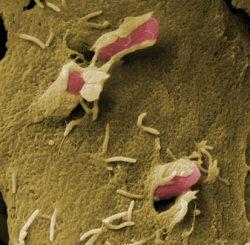
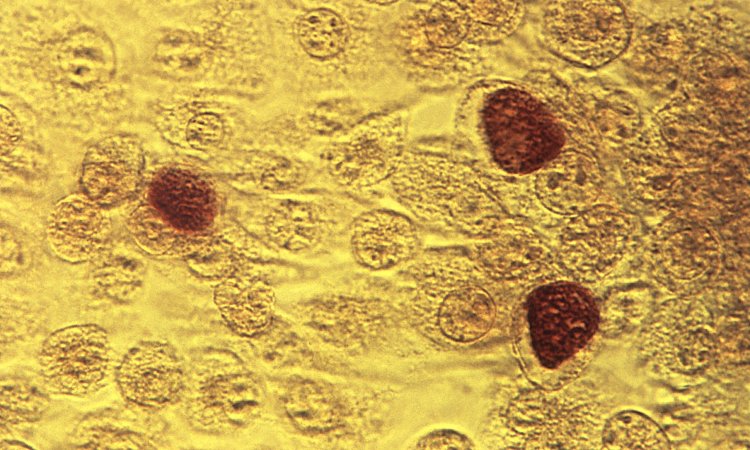
Bakterien der Gattung Yersinia können beim Menschen schwere Darmerkrankungen und auch die Pest auslösen. Die Erbinformation für Werkzeuge, die diese Bakterien erst gefährlich machen, tragen Yersinien auf einem gesonderten DNA-Molekül, dem Virulenzplasmid. Ohne diesen DNA-Ring, der unabhängig vom übrigen Erbmaterial in den Bakterien vorkommt, sind die Yersinien völlig harmlos. Das Virulenzplasmid trägt unter anderem den Bauplan für eine molekulare Spritze, mit der die Bakterien Substanzen in die Wirtszellen schießen und zum Beispiel deren Tod einleiten können. Die Forscher wussten bereits, dass die Bakterien bei einer Infektion ihre molekularen Spritzen in größerer Zahl ausbilden, doch wie genau es dazu kommt, war bis jetzt unbekannt.
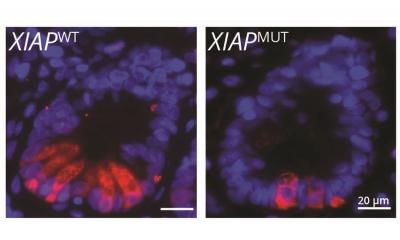
Um das Rätsel zu lösen, haben die Forscher um Abteilungsleiter Hans Wolf-Watz und Tomas Edgren von der Universität Umeå den Krankheitserreger Yersinia pseudotuberculosis in Kulturgefäßen angezogen und darin eine Infektion simuliert. Sie sequenzierten das gesamte genetische Material dieser aktivierten Bakterien und verglichen es mit ruhenden Bakterien. Das Ergebnis: Im Fall der simulierten Infektion besitzen die Bakterien auf einmal vier Kopien ihres Virulenzplasmids, das im Ruhezustand nur ein- bis zweimal in jeder Zelle vorliegt. An dieser Stelle stiegen die HZI-Forscher um Petra Dersch, Leiterin der Abteilung Molekulare Infektionsbiologie, in das Projekt ein. Sie untersuchten an mit Yersinien infizierten Mäusen, wie es zu der erhöhten Kopienzahl des Plasmids im lebenden Organismus kommt. „Die Bakterien sind erst dann richtig virulent, wenn sie vier Plasmidkopien enthalten“, sagt Dersch. „Das ist eine völlig neue Erkenntnis, und den Mechanismus dahinter konnten wir jetzt mithilfe neuester Sequenziertechnik am HZI aufklären.“
Aaron Nuss, Postdoktorand in Derschs Abteilung, isolierte mit einer sehr aufwendigen Methode aus den infizierten Mäusen die gesamten Abschriften der Bakterien-DNA und sequenzierte sie. Anhand dieser Abschriften, der sogenannten RNA, lässt sich feststellen, welche Gene gerade aktiv sind und zur Produktion von Proteinen herangezogen werden. Dabei fiel auf, dass unter anderem die Replikase – das Enzym, das das Plasmid vervielfältigt – bei einer Infektion verstärkt gebildet wird. Im Ruhezustand wird die Produktion dieses Enzyms von bestimmten Faktoren gedrosselt.
Beim Kontakt mit einer Immunzelle setzt jedoch ein gegensätzlicher Effekt ein: Die Bakterien beseitigen sofort die hemmenden Faktoren und bilden mehr Replikase, die das Virulenzplasmid vervielfältigt. Damit werfen die Yersinien ihre Abwehrmechanismen an, die die Immunzelle schließlich abtöten. „Dieses Programm starten die Yersinien vor allem beim Kontakt mit Immunzellen, um sich schnellstmöglich vor deren Angriff zu schützen“, sagt Petra Dersch. „Das kostet sie so viel Energie, dass sie vorübergehend sogar ihr Wachstum einstellen müssen.“
Die neuen Erkenntnisse sind das Ergebnis einer engen Kooperation: Hans Wolf-Watz hat im Frühjahr einen dreimonatigen Forschungsaufenthalt in Derschs Abteilung absolviert, Tomas Edgren kam für zwei Wochen ans HZI. Während dieser Zeit haben die Wissenschaftler gemeinsam einen großen Teil der Untersuchungen an den infizierten Mäusen durchgeführt. Die Veröffentlichung im Fachjournal Science ist allerdings kein Abschluss der Kooperation: „Wir möchten die Mechanismen der Yersinien-Infektion zusammen noch weiter aufklären, denn dahinter verbergen sich auch Angriffspunkte für mögliche Medikamente, die die Bakterien unschädlich machen könnten“, sagt Petra Dersch.
Originalpublikation:
Increased Plasmid Copy-number is Essential for Yersinia T3SS Function and Virulence: H. Wang, K. Avican, A. Fahlgren, S. Erttmann, A. M. Nuss, P. Dersch, M. Fallman, T. Edgren, H. Wolf-Watz. Science, 2016, DOI: 10.1126/science.aaf7501
Link: http://science.sciencemag.org/content/early/2016/06/29/science.aaf7501
Quelle: Helmholtz-Zentrum für Infektionsforschung
07.07.2016