News • Glucagonrezeptor GCGR
Neue Möglichkeiten für die Entdeckung von Diabetes-Medikamenten
Das komplexe Gefüge eines an ein Analogon seines endogenen Liganden gebundenen Klasse B-GPCR sorgt für neue Anreize in der GPCR-Forschung
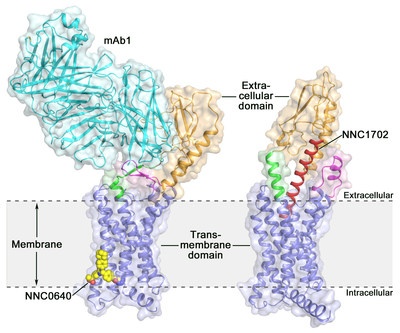
Die Aktivierung des menschlichen Glucagonrezeptors (GCGR) durch seinen endogenen Liganden Glucagon löst während des Fastens die Freisetzung von Glukose aus der Leber aus, und ist von daher ein potenzielles Wirkstofftarget für Typ-2-Diabetes. Kürzlich gelang es Wissenschaftlern vom Shanghai Institute of Materia Medica (SIMM) der Chinesischen Akademie der Wissenschaften in Zusammenarbeit mit mehreren Forschungsgruppen in China, Dänemark, Kanada und den Vereinigten Staaten die Kristallstruktur von GCGR in Komplex mit dem Glucagon-Analogon NNC1702 zu bestimmen, was erstmals mit hoher Auflösung die molekularen Details eines GPCR der Klasse B enthüllt, das an seinen Peptidliganden bindet. Zugleich offenbart sich hier unverhofft die strukturelle Komplexität, die die Rezeptoraktivierung steuert, was das Verständnis der Klasse B-GPCR Signaltransduktion erheblich erweitert. Die Studie wurde in Nature veröffentlicht.
Die frisch enträtselte GCGR-Struktur bietet die bisher genaueste Vorlage für auf GCGR ausgerichtetes Drug Design
Beili Wu
Die spannendste Erkenntnis dieser Studie ist, dass die als „Stalk" bezeichnete Linkerregion, die ECD und TMD des Rezeptors verbindet, und der erste extrazelluläre Loop signifikante Konformationsänderungen durchlaufen, die zu einer deutlichen Veränderung der Relativen Orientierung zwischen der ECD und TMD des Rezeptors führen, um die Peptidbindung zu ermöglichen und die Aktivierung des Rezeptors zu initiieren. Der Stalk kann darüber hinaus die Aktivität des Rezeptors durch Unterstützung der konformativen Veränderungen der Rezeptor-TMD modulieren.
Die Forscher führten eine Reihe von funktionellen Studien durch, bei denen sie unter anderem folgende Techniken anwandten: Competitive Ligand Binding, Cell Signaling, Molekulardynamiksimulationen und Doppel-Elektron-Elektron-Resonanz (DEER)-Spektroskopie. Die Ergebnisse belegen die GCGR-Struktur und bestätigen Konformationsänderungen des Rezeptors in verschiedenen Funktionszuständen. „Die frisch enträtselte GCGR-Struktur hilft uns nicht nur, die Mechanismen der Signalerkennung bei GPCRs der Klasse B zu verstehen, sondern bietet auch die bisher genaueste Vorlage für auf GCGR ausgerichtetes Drug Design, was neue Möglichkeiten in der Arzneimittelforschung für die Behandlung von Typ-2-Diabetes eröffnet", sagte Teamleiterin und SIMM Professorin Dr. Beili Wu.
Quelle: Shanghai Institute of Materia Medica, Chinese Academy of Sciences
04.01.2018