News • Zellaktivität erforschen
Einzelne Rezeptoren bei der Arbeit erwischt
Bei der Suche nach neuen Medikamenten gegen Krankheiten wie Bluthochdruck, Asthma oder Parkinson zählen sogenannte G-Protein-gekoppelte Rezeptoren (GPCRs) zu den ganz besonders „heißen Kandidaten“. Schließlich sind sie für viele Hormone und Neurotransmitter der Ansatzpunkt, über den diese auf die Aktivität von Zellen einwirken. Dementsprechend greifen heute schon rund die Hälfte aller verschreibungspflichtigen Medikamente an diesen Rezeptoren an – und helfen so bei der Behandlung weitverbreiteter Krankheiten.
Damit sie Prozesse im Zellinneren in Gang setzen und steuern können, müssen – wie der Name verrät – Rezeptoren und G-Proteine zunächst zueinander finden. Wie und wo das passiert, war lange Zeit Gegenstand zahlreicher Hypothesen, die jedoch nie bestätigt werden konnten. Einem internationalen Team von Wissenschaftlern aus Universitäten in Würzburg, Birmingham und Wrocław ist es jetzt erstmalig gelungen, die „Kontaktanbahnung“ zwischen einzelnen Rezeptoren und G-Proteinen und das weitere Geschehen live auf der Oberfläche von lebenden Zellen zu beobachten und zu untersuchen.
Hot Spot Treffen
Wir konnten zeigen, dass Rezeptoren und G-Proteine sich bevorzugt an speziellen Orten auf der Plasmamembran treffen, die wir als ‚Hot Spots‘ bezeichnen
Professor Davide Calebiro
Das Ergebnis: „Wir konnten zeigen, dass Rezeptoren und G-Proteine sich bevorzugt an speziellen Orten auf der Plasmamembran treffen, die wir als ‚Hot Spots‘ bezeichnen“, erklärt Professor Davide Calebiro, Hauptautor der Studie, die jetzt in der renommierten Fachzeitschrift Nature erschienen ist. Calebiro forscht am Institut für Pharmakologie und Toxikologie und am Bio-Imaging Center der Universität Würzburg sowie am Centre of Membrane Proteins and Receptors der Universitäten von Birmingham und Nottingham.
Mit Hilfe einer modifizierten Variante der Einzelmolekül-Mikroskopie war es den Wissenschaftlern möglich, diese detaillierten Beobachtungen an der Zellmembran zu machen. Dabei konnten sie auch sehen, dass Rezeptoren und G-Proteine in der Regel nur vorübergehend miteinander in Kontakt stehen – ihr Zusammenwirken war in der Mehrzahl der Fälle nach nur einer Sekunde wieder beendet. Weiter fanden die Forscher heraus, dass das Zytoskelett der Zelle bei der Bildung der Hot Spots eine wichtige Rolle spielt. Diese Treffpunkte auf der Zelloberfläche waren bisher unbekannt gewesen.
Neue Technik - Neue Einsichten
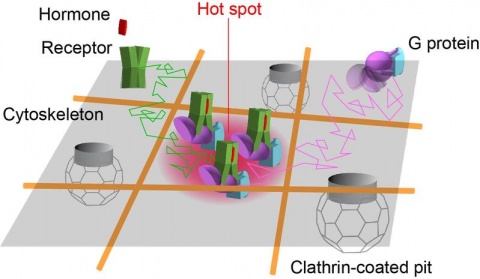
Calebiro und seine Ko-Autoren sind davon überzeugt, dass Hot Spots Einfluss auf die Aktivierung der G-Proteine ausüben, indem sie sowohl die Geschwindigkeit als auch die Effizienz dieser Prozesse steigern. Gleichzeitig sorgen sie dafür, dass die Signalübertragung räumlich beschränkt werden kann. Die neuen Erkenntnisse zeigen nach Meinung der Wissenschaftler, dass „anscheinend einfache biologische Prozesse äußerst komplex sein können, wenn man sie aus der Nähe betrachtet“. Dementsprechend gehen sie davon aus, dass die derzeitigen „außergewöhnlichen Fortschritte“ bei den bildgebenden Verfahren zu einem deutlich vertieften Verständnis dieser Prozesse führen werden.
Ihre jetzt gewonnenen Erkenntnisse bieten nach ihren Worten die Chance auf neue therapeutische Ansätze. „Bisher gängige Wirkstoffe arbeiten so, dass sie die Rezeptoren entweder blockieren oder aktivieren“, erklärt Davide Calebiro. In Zukunft könnte es möglich sein, selektiver auf diese Prozesse einzuwirken – beispielsweise indem man die Mobilität von Rezeptoren und G-Proteinen auf der Zellmembran oder deren Interaktionen an den Hot Spots manipuliert.
Quelle: Universität Würzburg
20.10.2017


