News • Makrophagen
Wie Immunzellen Bakterien mit Säure töten
Die erste Verteidigungslinie der Immunabwehr gegen eindringende Krankheitserreger sind Makrophagen.
Diese Fresszellen umschließen ihre Beute mit einer Membran und nehmen sie in das Zellinnere auf, wo sie innerhalb der sog. Phagosomen durch zunehmende Ansäuerung abgetötet wird – ein Prozess, der noch nicht zur Gänze verstanden ist. Innerhalb des Großprojekts zur systematischen Erforschung aller Proteine, die chemische Substanzen durch Zellmembranen transportieren, haben CeMM-WissenschaftlerInnen den Transporter SLC4A7 charakterisiert; ein Membranprotein, das entscheidend für die Phagosom-Ansäuerung ist. Die Ergebnisse liefern wertvolle Erkenntnisse für eine Vielzahl an Erkrankungen.
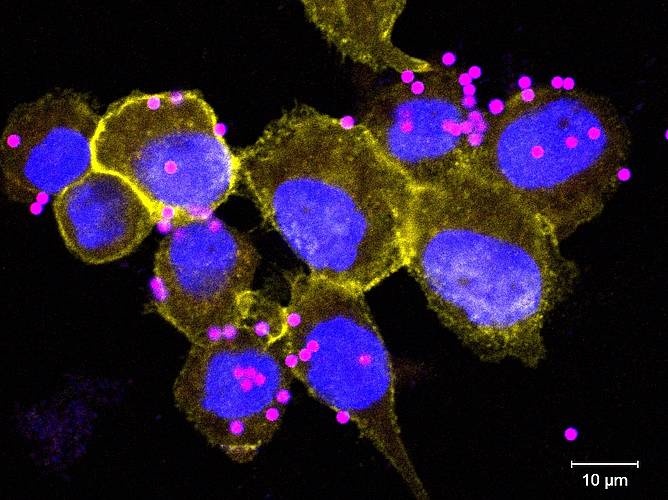
Unter den vielfältigen Immunzellen, die im Körper patrouillieren, gehören Makrophagen zu den ersten, die eindringende Fremdkörper abwehren. Mit ihrer flexiblen und wandlungsfähigen Oberfläche stülpen sie sich über jeden Eindringling, der für den Organismus gefährlich werden könnte, und verschließen ihn in einer intrazellulären Membranblase, dem sogenannten Phagosom. Anschließend muss der pH-Wert in der Blase schrittweise und effektiv gesenkt werden, bis er einer starken Säure gleicht, um die eingeschlossenen Mikroben abzutöten. Viele Details dieses entscheidenden Prozesses, im Fachjargon Phagozytose genannt, sind bisher nicht gänzlich verstanden. Das Team von Giulio Superti-Furga, wissenschaftlicher Direktor des CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften, konnte in seiner neuesten Studie zeigen, dass ein Membranprotein aus der Familie der "Solute Carriers" (SLCs) für Makrophagen essenziell ist, um während der Phagozytose ihre Beute tatsächlich mit Säure abtöten zu können. Ihre Arbeit wurde in der Fachzeitschrift Cell Host & Microbe veröffentlicht.
Wenn SLC4A7 ausgeschaltet wird, häufen sich positiv geladenen Protonen im Zellplasma an, was die Säurebildung in den Phagosomen verhinder
Giulio Supert-Furga
SLCs sind die größte Gruppe der Transportproteine einer Zelle. Sie sind dafür verantwortlich, chemische Substanzen durch Zellmembranen zu schleusen. Da die Phagozytose den Austausch von Ionen und anderen Stoffen erfordert, stellten die WissenschaftlerInnen von Superti-Furgas Team die Hypothese auf, dass SLC's für diesen Prozess in Makrophagen eine zentrale Rolle einnehmen. Um diese Hypothese zu überprüfen, entwickelten sie einen experimentellen Ansatz, bei dem sie mit Hilfe der Genom-Editierungs-Technik CRISPR/Cas9 in einer Makrophagen-Zelllinie alle 391 menschlichen SLC-Gene einzeln ausschalteten. Diese Zellen – jede mit einem einzigen defekten SLC-Gen – wurden daraufhin bei der Phagozytose beobachtet, um herauszufinden, ob sich die Gendefekte darauf auswirkten. Unter allen SLCs war SLC4A7, ein Natrium-Bicarbonat Transporter, der einzige, der sich als essentiell für die Ansäuerung von phagozytierten Mikroben erwies. Zellen, bei denen dieses Gen ausgeschaltet war, waren unfähig ihre Phagosomen anzusäuern, und damit auch nicht in der Lage, aufgenommene Bakterien abzutöten.
Mit SLC4A7 hatten die ForscherInnen ihren Hauptverdächtigen identifiziert und untersuchten nun, in Kollaboration mit der Forschungsgruppe von Nicolas Demaurex von der Universität Genf genauer, auf welche Weise dieses Protein die Ansäuerung der Membranblasen beeinflusst. "SLC4A7 befindet sich auf der Oberfläche der Makrophagen und ist für den Import von Bicarbonat, also dem Salz der Kohlensäure, aus der Umgebung in das Zellinnere verantwortlich", erklärt Giulio Supert-Furga, der Letztautor der Studie. "Dieser Import ist essentiell für die Stabilisierung des zellulären pH-Werts während der Phagozytose ist. Wenn SLC4A7 ausgeschaltet wird, häufen sich positiv geladenen Protonen im Zellplasma an, was die Säurebildung in den Phagosomen verhindert."
Die Ergebnisse dieser Studie liefern neue, fundamentale Erkenntnisse über die molekularen Mechanismen und die Biologie der Makrophagen, einer der wichtigsten Arten von Immunzellen. Da die Phagozytose in einer ganzen Reihe von Erkrankungen, von Infektionskrankheiten bis hin zu Krebs, eine wichtige Rolle spielt, könnten die Ergebnisse darüber hinaus auch für medizinische Zwecke nützlich sein, etwa bei der Entwicklung neuer Therapien oder Wirkstoffe. Die vom Europäischen Forschungsrat geförderte Studie ist ein weiterer Beitrag in dem Bestreben, die Rolle der verschiedenen zellulären Transporter zu verstehen.
Quelle: MEDICA/Medizinische Universität Wien
25.05.2018