Onkologen begrüßen neue EU-Verordnung zu klinischen Studien
Eine Chance für den Forschungsstandort Deutschland
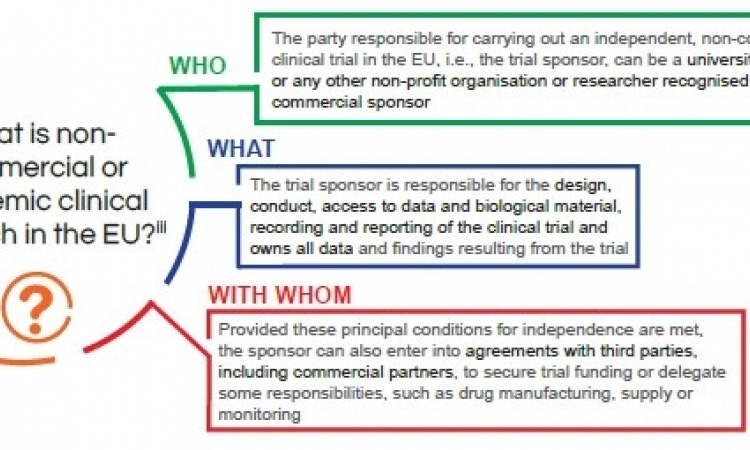
Am 12. April 2014 wurde im Europäischen Parlament eine novellierte Verordnung zu klinischen Studien verabschiedet. Auf einer Pressekonferenz machten die DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.V. und die Gesellschaft für Pädiatrische Onkologie und Hämatologie e.V. (GPOH) jetzt deutlich, dass die Durchführung von klinischen Studien für die Weiterentwicklung von Therapiemöglichkeiten bei Blut- und Krebserkrankungen und für den Forschungsstandort Deutschland von immenser Bedeutung ist.

Die Verfahren für die Bewertung und die Genehmigung von klinischen Studien müssen in Deutschland an die EU-Verordnung angepasst werden. Hierzu und zu weiteren unmittelbar damit zusammenhängenden Fragen stellten die DGHO und die GPOH ihre Forderungen vor.
Klinische Studien sind die Grundlage der evidenzbasierten Medizin. In Folge einer Gesetzesnovelle zu klinischen Studien aus dem Jahr 2001 ist die Anzahl, vor allem von Investigator-initiierten, pharmaunabhängigen Studien bei hämatologischen und onkologischen Erkrankungen, aufgrund von administrativen Hürden allerdings deutlich zurückgegangen. Vor diesem Hintergrund betont Prof. Mathias Freund, Geschäftsführender Vorsitzender der DGHO e.V., die zentrale Notwendigkeit klinischer Studien. "Die jetzige EU-Verordnung hat für klinische Studien in jedem Fall Fortschritte gebracht. Dazu gehören einheitliche Genehmigungsverfahren auf europäischer Ebene und die Straffung von Abläufen durch enge Fristsetzungen. Darüber hinaus begrüßen wir als Fachgesellschaft die Implementierung eines elektronischen Antragsverfahrens und die jetzt vorgenommene angemessene Berücksichtigung der Ethik-Kommissionen in der Verordnung." Außerdem sei die Einführung der Begrifflichkeit der minimal-interventionellen Studien zu begrüßen. Dabei profitierten vom Einsatz zugelassener Medikamente außerhalb der originären Indikationsstellung (Off-Label-Use) besonders die pädiatrischen Studien und damit Kinder mit Krebserkrankungen.
Darüber hinaus, so Freund, müssten bei der Umsetzung der EU-Verordnung in Deutschland eine ganze Reihe von Aspekten berücksichtigt werden. Auf der Pressekonferenz stellten die DGHO und GPOH nun konkrete Forderungen auf.
Forderungen der DGHO und der GPOH
Professionalisierung und Straffung der Abläufe in Deutschland bei der Bewertung und Genehmigung
• Direktes Zusammenwirken der Bundesoberbehörden (BOB) und der Ethikkommissionen (EK) bei der Bewertung von Teil I und Teil II und der Genehmigung von klinischen Studien
• Keine Implementierung einer weiteren Koordinationsstelle, beispielsweise beim Bundesministerium für Gesundheit (BMG)
• Effiziente und sachlich angemessene Zusammenarbeit von BOB und EK
Prüfung der Eignung der Prüfstätten und der Qualifikation der Prüfer durch die Bundesoberbehörden in Zusammenarbeit mit den Landesbehörden
• Schaffung einer Möglichkeit zur Akkreditierung von Prüfstätten und ihres Personals bei den Landesbehörden
• Rahmensetzung für Kriterien durch die BOB
• Wahlweise auch Benennung von Prüfstätten mit Personal im Rahmen einzelner Studien
Vereinfachung des Monitorings bei minimalinterventionellen klinischen Prüfungen
• Ausschöpfen der Möglichkeiten in Ausführungsbestimmungen und Entscheidungspraxis
Minimalinterventionelle klinische Prüfungen bewegen sich im Rahmen etablierter Verfahren für Diagnose und Therapie
• Kosten der Diagnose und Therapie sollten von den Kostenträgern im Rahmen klinischer und ambulanter Therapie voll übernommen werden
• Entsprechende Anpassung des SGB V § 35c für ambulante Studien
• Klarstellung für den stationären Bereich in diesem Sinne (SGB V § 137c, Krankenhausentgeltgesetz § 8, Bundespflegegesetzverordnung § 10)
• Dokumentationsaufwand und wissenschaftliche Begleituntersuchungen sind zusätzlicher Studienaufwand und müssen im Rahmen der Studie gesondert finanziert werden
Schaffung einer Stiftung Klinische Studien
• In einem ersten Schritt zuständig für die Bereitstellung eines Entschädigungsmechanismus für Probanden in minimalinterventionellen klinischen Prüfungen
• Finanzierung durch Kostenträger und Bund
• Schaffung der entsprechenden rechtlichen Voraussetzungen im SGB V
• Weiterer Aufbau der Stiftung zur Finanzierung von minimalinterventionellen klinischen Studien
Vereinheitlichung der Genehmigung diagnostischer und therapeutischer Verfahren mit ionisierender Strahlung / CT, Röntgen, Nuklearmedizin, Strahlentherapie im Rahmen von Studien
• Erstellung des Berichtes Teil I und II und Entscheidung durch Bundesoberbehörden sowie die zuständige Ethik-Kommission in einem Votum für alle Aspekte der Studie einschließlich der oben genannten Diagnostik und Therapie
• Bundesamt für Strahlenschutz (BfS) übernimmt beratende Rolle
• Wirksamkeit der in der EU-Verordnung vorgesehenen Fristen für das gesamte Verfahren
Mit Blick auf die konkreten Forderungen der DGHO und der GPOH betonte Freund: "Mit unseren Forderungen wollen wir als Fachgesellschaft deutlich machen, dass klinische Studien ein höchst effektives Instrument im Rahmen der Entwicklung neuer therapeutischer Interventionsmöglichkeiten bei Krebserkrankungen sind." Mit den Forderungen der Fachgesellschaft, so der Geschäftsführende Vorsitzende, wolle man einen Diskussionsprozess anstoßen und mit Blick auf die Umsetzung der EU-Verordnung in nationales Recht dazu beitragen, dass der Forschungsstandort Deutschland für die Durchführung klinischer Studien wieder attraktiver wird. "Davon profitieren vor allem auch unsere Patientinnen und Patienten", so Freund.
Für die GPOH machte die Vorsitzende, Prof. Angelika Eggert, klar: "Die Finanzierung medizinischer Innovation wird von den Stakeholdern des deutschen Gesundheitssystems nicht ausreichend unterstützt. Das muss sich ändern, wenn Deutschland in der Medizin international nicht den Anschluss verlieren will."
17.06.2014