© HZI/Muesken
News • Enzym reguliert Pathogenität des Erregers
Neuer Ansatz gegen Pseudomonas aeruginosa
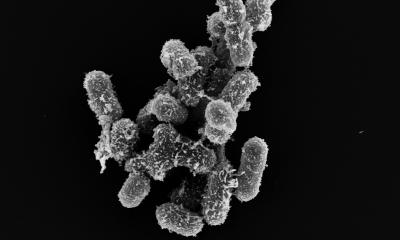
Pseudomonas aeruginosa ist ein gefährlicher Krankenhauskeim, der Atemwege und Lunge befällt. Für Personen mit geschwächtem Immunsystem oder schweren Atemwegserkrankungen kann eine Infektion mit dem Bakterium lebensbedrohlich sein.
Wirksame Behandlungsmöglichkeiten gibt es bislang nicht. Forscher vom Twincore, Zentrum für Experimentelle und Klinische Infektionsforschung in Hannover, sowie des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig konnten nun zeigen, dass ein Enzym die krankmachende Wirkung des Erregers – seine Pathogenität – durch Modifikation von tRNA-Molekülen kontrolliert. Sie hoffen, dass sie mit ihren Ergebnissen den Weg für die Entwicklung neuer Behandlungsmöglichkeiten ebnen können. Die Studie ist in der Fachzeitschrift Proceedings of the National Academy of Sciences (PNAS) erschienen.
Eine Ansteckung mit Pseudomonas aeruginosa kann von Mensch zu Mensch erfolgen. Sie ist aber auch in Bad, Küche oder in der Natur möglich, da sich das Bakterium überall wohlfühlt, wo es feucht ist: in Leitungswasser, Spülmaschine, Waschbecken, Dusche oder Toilette. Auch in Böden und Gewässern kommt es vor. „Das Problem ist: Man kann Pseudomonas aeruginosa nicht wirklich aus dem Weg gehen“, sagt Prof. Susanne Häußler, Leiterin des Instituts für Molekulare Bakteriologie am Twincore und der gleichnamigen Abteilung am HZI. „Hinzu kommt, dass die Bakterien im Körper einen gemeinschaftlichen Biofilm ausbilden, der sie schützt. Das ist eine Art Schleimschicht, hinter der sie sich vor Immunzellen und Antibiotika verschanzen.“ Auf diese Weise ist P. aeruginosa von Natur aus gegenüber einer Vielzahl von Antibiotika unempfindlich und gehört deshalb zu den problematischen Krankenhauskeimen. Mit Hochdruck wird an der Entwicklung sogenannter Pathoblocker geforscht, die anders als Antibiotika nicht das Abtöten des Erregers zum Ziel haben, sondern seine Pathogenität zu verhindern oder zu schwächen.
Können tRNA-Moleküle nicht durch GidA modifiziert werden, verliert Pseudomonas aeruginosa deutlich an Schlagkraft [...]. Mit Blick auf neue mögliche Ansatzpunkte für die Entwicklung von Pathoblockern sind das äußerst vielversprechende Ergebnisse
Nicolas Oswaldo Gomez
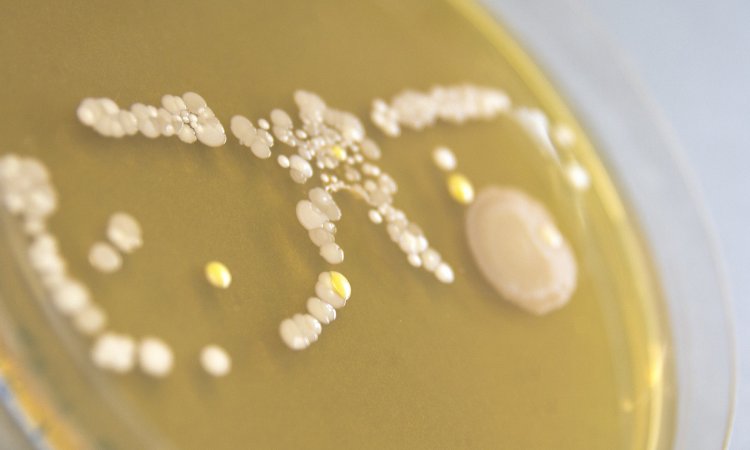
Aus Studien ist bekannt, dass ein Enzym namens GidA bei P. aeruginosa an der Kommunikation (Quorum Sensing) zwischen den Bakterienzellen sowie der Ausbildung des Biofilms maßgeblich mitbeteiligt ist. Könnte GidA womöglich auch für die Pathogenität von P. aeruginosa zentral und somit ein möglicher Angriffspunkt für künftige Pathoblocker sein? Dieser Frage ist das Team um Susanne Häußler in seiner aktuellen Studie nachgegangen. GidA ist ein Enzym, das sogenannte tRNA-Moleküle modifiziert. tRNA-Moleküle sind durch ihre Fähigkeit, den genetischen Code zu entschlüsseln, an der Proteinproduktion beteiligt – und GidA gibt einigen von ihnen dafür quasi den letzten Schliff. „Wir untersuchten, was passiert, wenn GidA keine Veränderungen mehr an tRNA-Molekülen vornehmen kann, und zwar mit Blick auf die Pathogenität von Pseudomonas aeruginosa“, sagt HZI-Wissenschaftler Dr. Nicolas Oswaldo Gomez, der einer der Erstautoren der Studie ist. Für ihre Untersuchungen stellten die Forschenden mithilfe genetischer Verfahren einen Bakterienstamm von P. aeruginosa her, der nicht mehr in der Lage war, das Enzym GidA herzustellen. Mittels Zellkulturen und Tiermodellen verglichen die Forschenden die Pathogenität der genetisch veränderten Bakterien mit der des Wildtyps. „In allen Versuchen war die Pathogenität im Vergleich zum Wildtyp deutlich reduziert. Ist GidA nicht vorhanden, werden einige tRNA-Moleküle nicht mehr verändert, was offensichtlich dazu führt, dass für die Pathogenität entscheidende Proteine nicht mehr hergestellt werden“, sagt Gomez. „So konnten wir in weiteren Untersuchungen zum Beispiel feststellen, dass die Struktur des Biofilms verändert war, und dass ein Chinolon-Antibiotikum deutlich effektiver wirkte als beim Wildtyp.“ Häußler ergänzt: „Können tRNA-Moleküle nicht durch GidA modifiziert werden, verliert Pseudomonas aeruginosa deutlich an Schlagkraft, und der Biofilm-Schutzwall wird durchlässig. Mit Blick auf neue mögliche Ansatzpunkte für die Entwicklung von Pathoblockern sind das äußerst vielversprechende Ergebnisse.“
Dieser Artikel könnte Sie auch interessieren

Artikel • Hygiene allein reicht nicht
Maßgeschneiderte Infektionsprävention im Kampf gegen Krankenhauskeime
Krankenhausinfektionsraten stagnieren, Infektionen mit multiresistenten Erregern nehmen sogar ab. Dennoch ist Prof. Dr. Petra Gastmeier davon überzeugt, dass sich die Krankenhaushygiene in den kommenden Jahren deutlich verändern wird und muss. Im Interview spricht die Direktorin des Instituts für Hygiene und Umweltmedizin der Charité über aktuelle Herausforderungen und künftige Trends.
Mit Hilfe verschiedener OMICS-Methoden und bioinformatischer Analysen konnten die Forschenden des Weiteren zeigen, welche Typen von tRNA-Molekülen an welchen Stellen wie genau durch GidA verändert werden. Und dass diese veränderten tRNA-Moleküle nur bei der Synthese bestimmter Proteine und dabei entweder am Anfang oder am Ende der zu entschlüsselnden Gene zum Zug kommen. „Die Ergebnisse unserer Studie machen deutlich, dass die Pathogenität von Pseudomonas aeruginosa einem spezialisierten epigenetischen Steuerungsprozess unterliegt, bei dem GidA wie eine Art übergeordneter Schalter funktioniert“, sagt Häußler. „Und diesen können und sollten wir nutzen – als Ansatzpunkt für die Entwicklung wirksamer Pathoblocker gegen Pseudomonas aeruginosa und andere hochproblematische bakterielle Erreger.“ In nachfolgenden Studien wollen die Forschenden nach weiteren Enzymen fahnden, die an der Modifikation von tRNA-Molekülen beteiligt sind.
An der Studie waren neben den Forschenden von Twincore und HZI weitere Kooperationspartner aus mehreren Forschungseinrichtungen beteiligt, unter anderem die Medizinische Hochschule Hannover, die Universität Würzburg und die Universität Hamburg.
Quelle: Twincore, Zentrum für Experimentelle und Klinische Infektionsforschung; Autorin: Nicole Silbermann
15.03.2024