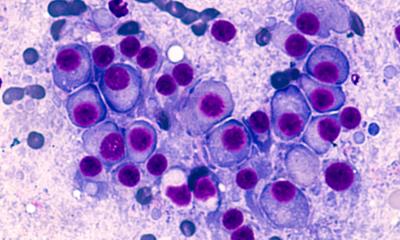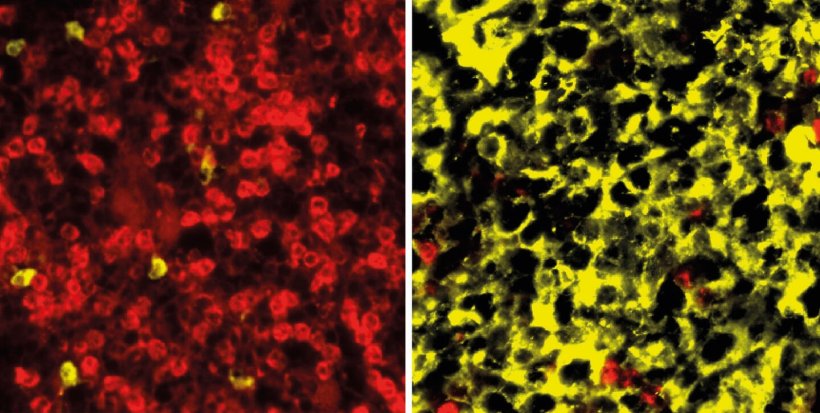
© AG Janz, Max Delbrück Center
News • Blutkrebs-Foschung
Krankheitsmodelle für Multiples Myelom entwickelt
Forschenden um Martin Janz und Klaus Rajewsky ist es am Max Delbrück Center gelungen, genetisch definierte Mausmodelle für zwei Subtypen des Multiplen Myeloms zu entwickeln. Sie helfen, die Entwicklung der Krankheit beim Menschen genauer zu verstehen.
Darüber berichtet das Team im Magazin „PNAS“.
B-Lymphozyten, kurz B-Zellen, sind zentrale Akteure des Immunsystems. Dringen Krankheitserreger in den Körper ein, werden B-Zellen aktiv und entwickeln sich zu Plasmazellen, die Antikörper freisetzen. Ein wichtiger Schritt ist dabei die Keimzentrumsreaktion. Wird der Reifungsprozess der B-Zellen zu Plasmazellen gestört, kann ein Multiples Myelom entstehen, eine der häufigsten Blutkrebs-Erkrankungen, die in verschiedenen Subtypen auftreten kann und bisher nicht heilbar ist.
Multiple Myelome entwickeln sich sehr langsam und in einem mehrstufigen Prozess. Den Anstoß geben spontane genetische Defekte, die im Rahmen der Keimzentrumsreaktion auftreten und den Reifungsprozess der B-Zellen beeinflussen. Es bildet sich zunächst eine Vorstufe der Erkrankung, die noch gutartig ist. In diesem Stadium – monoklonale Gammopathie unbekannter Signifikanz (MGUS) genannt – haben die Patienten noch keine Symptome. Lediglich die Konzentration des von den Plasmazellen gebildeten Antikörpers im Blut ist erhöht. Erst wenn weitere genetische Veränderungen in den Plasmazellen dazu kommen, wird die Grenze zum Krebs unwiderruflich überschritten.
Es war beeindruckend zu sehen, dass die primäre Veränderung im Mausmodell – entweder durch Überexpression von Cyclin D1 oder MMSET – wirklich das Bild des Subtyps der Erkrankung prägt
Klaus Rajewsky
Bisherige Mausmodelle konnten die unterschiedlichen genetischen Unterformen des Myeloms nicht präzise abbilden. Einem gemeinsamen Team um den B-Zellforscher Professor Klaus Rajewsky und den Lymphom-Experten Dr. Martin Janz ist dies nun gelungen: Im Magazin „PNAS“ berichten sie über neuartige Mausmodelle, die zwei Subtypen des humanen Multiplen Myeloms genau widerspiegeln. „Darüber hinaus konnten wir zeigen, wie entscheidend das Zusammenwirken mehrerer genetischer Defekte für die Entstehung des Multiplen Myeloms ist“, betont Martin Janz vom Labor für Maligne Lymphome des Experimental and Clinical Research Centers (ECRC), einer gemeinsamen Einrichtung vom Max Delbrück Center und der Charité – Universitätsmedizin Berlin.
Zunächst etablierten die Forschenden drei unterschiedliche Gruppen von transgenen Mäusen, die jeweils nur eine genetische Veränderung tragen – entweder eine zusätzliche Kopie der Gene Cyclin D1, MMSET oder Ikk2. Cyclin D1 reguliert den Zellzyklus. Wird dieses Gen durch einen Defekt falsch aktiviert, wird die Zellteilung vorangetrieben. MMSET, eine Histon-Methyltansferase, reguliert die Zugänglichkeit der DNA. Wird das Gen dafür verstärkt abgelesen, verändert sich das epigenetische Muster der Zelle tiefgreifend, ihre Empfänglichkeit für eine bösartige Entartung erhöht sich. Ikk2 kodiert für eine Komponente des NF-KappaB-Signalweges (NF-κB), der eine wichtige Rolle beim Zellwachstum und der Immunantwort spielt. Beim Multiplen Myelom ist diese Signalkette häufig aktiviert.
Im zweiten Schritt kreuzten die Wissenschaftler die Cyclin D1- sowie die MMSET-Mäuse jeweils mit Ikk2-Mäusen und wählten die Nachkommen mit den gewünschten Merkmalen aus – also Cyclin D1 + Ikk2 sowie MMSET + Ikk2. Anschließend verpaarten sie diese mit einem weiteren Mausstamm, durch den die veränderte genetische Information nur in den B-Zellen und auch nur im Rahmen der Keimzentrumsreaktion aktiviert werden kann. „Es war beeindruckend zu sehen, dass die primäre Veränderung im Mausmodell – entweder durch Überexpression von Cyclin D1 oder MMSET – wirklich das Bild des Subtyps der Erkrankung prägt“, sagt Klaus Rajewsky.
Unsere Modelle schaffen eine wichtige Basis, um die Unterschiede und Gemeinsamkeiten zwischen den verschiedenen Subgruppen zu untersuchen und auf lange Sicht spezifischere, jeweils angepasste Therapiekonzepte entwickeln zu können
Wiebke Winkler
Bis sich bei den Mäusen das Vollbild eines Multiplen Myeloms entwickelt, dauert es 70 bis 90 Wochen – eine lange Zeit in einem Mäuseleben. Das erschwert zwar die Experimente, spiegelt aber die Entstehung der Krankheit beim Menschen gut wider: Multiple Myelome treten nämlich erst in höherem Lebensalter auf und gehen oft erst nach Jahren in das maligne Stadium über. Man schätzt, dass bei bis zu fünf Prozent aller über Siebzigjährigen die gutartige Vorstufe MGUS vorliegt. „Unsere Modelle verdeutlichen, dass ein Multiples Myelom tatsächlich erst dann entsteht, wenn mehrere genetische Defekte zusammenwirken“, erläutert Martin Janz. „Mäuse, die lediglich transgen bezüglich Cyclin D1 oder MMSET waren und kein verändertes Ikk2 trugen, entwickelten auch kein Multiples Myelom.“
Während sich die Symptome gleichen – erhöhte Kalziumwerte, Blutarmut, Fatigue, Infektneigung, Nierenschwäche, Knochenschäden –, unterscheiden sich die Subtypen des Multiplen Myeloms beim Menschen in der Art der genetischen Veränderungen, den Genexpressionsprofilen und der Prognose. „Unsere Modelle schaffen eine wichtige Basis, um die Unterschiede und Gemeinsamkeiten zwischen den verschiedenen Subgruppen zu untersuchen und auf lange Sicht spezifischere, jeweils angepasste Therapiekonzepte entwickeln zu können“, sagt Dr. Wiebke Winkler, Erstautorin der Studie.
Die Forschenden wollen die Mausmodelle zum einen dafür nutzen, um die „genetischen Achillesfersen“ der Untergruppen zu definieren, wie Martin Janz es nennt. Zum anderen wollen sie die B-Zellen in den Modellen noch zielgenauer aktivieren und weitere sekundäre genetische Veränderungen in das Mausgenom einbringen. „Ikk2 ist nicht der einzige treibende Faktor der Erkrankung“, betont Martin Janz.
Quelle: Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft; Text: Catarina Pietschmann
16.03.2023