Bildquelle: Leppkes et al., EBioMedicine 2020 (CC BY-NC-ND 4.0)
News • Verstopfte Gefäße durch Corona
Kann eine „Immunthrombose“ schwere COVID-Verläufe auslösen?
Das Coronavirus SARS-CoV-2 hat bis Mitte 2020 weltweit mehr als 600.000 Tote gefordert. Die Prozesse im Körper, die eine Infektion mit SARS-CoV-2 so gefährlich werden lassen, sind bislang nicht vollständig geklärt.
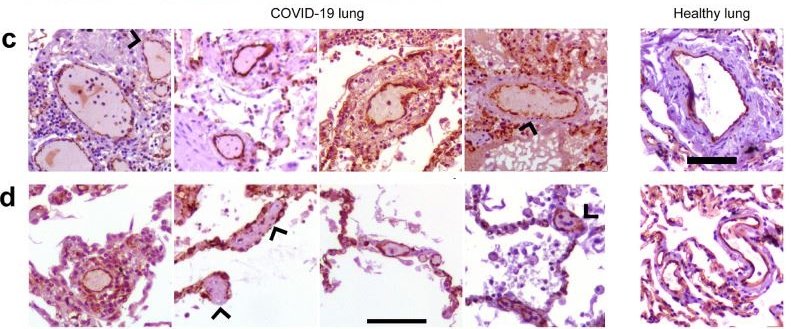
Ein Forscherteam der FAU Erlangen-Nürnberg um Dr. Moritz Leppkes, Oberarzt der Medizinischen Klinik 1 – Gastroenterologie, Pneumologie und Endokrinologie des Universitätsklinikums Erlangen, hat jetzt herausgefunden, dass bei COVID-19 bestimmte weiße Blutkörperchen, die neutrophilen Granulozyten, besonders stark aktiviert werden, sich zusammenballen und Netze oder sogenannte Neutrophil Extracellular Traps (NETs) in den Blutgefäßen der Lunge bilden. Die Blutgefäße verstopfen – und zwar nicht nur durch klassische Blutgerinnungsprozesse, sondern auch durch diese immunologisch bedingten Vorgänge, weshalb die Forscher hier zusätzlich von einer Immunthrombose sprechen. Die Folge: Die Sauerstoffversorgung beziehungsweise der Gasaustausch des Körpers ist nicht länger gewährleistet, was schwere Krankheitsverläufe nach sich zieht. Ihre Ergebnisse veröffentlichten die Forscher im Fachmagazin „EBioMedicine by The Lancet“.
Dieser Artikel könnte Sie auch interessieren

News • Studie zur Kreuzreaktivität
Können frühere Erkältungen vor schweren COVID-Verläufen schützen?
Eine Studie unter Leitung der Charité – Universitätsmedizin Berlin und des Max-Planck-Instituts für molekulare Genetik (MPIMG) zeigt: Einige gesunde Menschen besitzen Immunzellen, die das neuartige Coronavirus SARS-CoV-2 erkennen können. Der Grund könnte in vorhergehenden Infektionen mit landläufigen Erkältungs-Coronaviren liegen.
Die verstärkte Zusammenballung von neutrophilen Granulozyten und die darauffolgende NET-Bildung werden bei COVID-19 vermutlich durch die virale Schädigung des Endothels, der Auskleidung der Blutgefäße, hervorgerufen. Die Endothelzellen, genau wie die Zellen der Lungenbläschen, sind reich an ACE2, einem Rezeptor für das Coronavirus. Das Virus dockt an die Zellen an und schädigt sie. Die Endothel-Schädigung wiederum zieht neutrophile Granulozyten an, die eine wichtige Rolle bei der Immunabwehr spielen. Bei einer SARS-CoV-2-Infektion, das hat das Team um Dr. Leppkes herausgefunden, bildet sich vermehrt eine spezielle Form dieser Immunzellen – neutrophile Granulozyten geringer Dichte, die vermehrt zur NET-Bildung neigen und auch bei Autoimmunprozessen eine Rolle spielen. Bei Autoimmunvorgängen richtet sich das Immunsystem gegen die eigenen Körperzellen.
All diese Mechanismen führen – neben klassischen Blutgerinnungsprozessen und durch Blutplättchen hervorgerufenen Thrombosen – zu einer Verstopfung insbesondere der kleinen und kleinsten Blutgefäße der Lunge. Bis zu einem gewissen Grad ist die NET-Bildung bei Entzündungen zwar ein normaler Teil der Abwehr von Krankheitserregern, doch bei COVID-19 ist dieser Vorgang nicht auf einen Bereich eines Organs begrenzt, sondern kommt in vielen Blutgefäßen – auch verschiedener Organe – vor. Bedrohlich daran ist vor allem, dass sich die Mikro-Gefäße der Lungen rasch verschließen.
Bildquelle: Leppkes et al., EBioMedicine 2020 (CC BY-NC-ND 4.0)
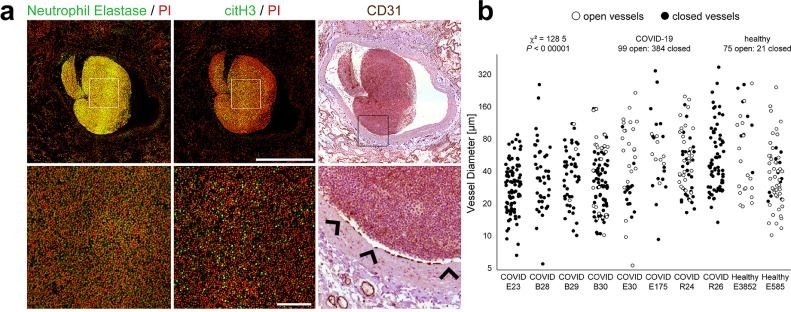
Ihre Erkenntnisse gewannen die Forscher unter anderem durch die immunhistochemische Analyse von Autopsiematerial sowie Blutproben von COVID-19-Patienten, die sie mit Proben von Gesunden und weniger schwer Erkrankten verglichen.
Die Forscher sehen einen Behandlungsansatz bei schweren COVID-19-Fällen darin, die Zusammenballung von neutrophilen Granulozyten zu hemmen und die vermehrte NET-Bildung zu verhindern. Dies könnte etwa durch Dexamethason geschehen, das Zellaggregation hemmt, sowie durch Wirkstoffe, die der NET-Bildung entgegenwirken, zum Beispiel indem sie PAD4-Enzyme angreifen. Die Wissenschaftler beobachteten auch eine bislang wenig beachtete Funktion des Blutgerinnungshemmers Heparin, der den Abbau von NETs unterstützt und so die Blutzirkulation verbessert.
Quelle: Universitätsklinikum Erlangen
04.08.2020