Hitzeschockproteine
Im Krisenfall HSF1
Ein Unfall oder ein Wohnungsbrand ‒ im Notfall rufen wir die Polizei und Feuerwehr. Eine Einsatzzentrale koordiniert schnelle Hilfe. Auch in den Zellen unseres Körpers gibt es Krisenhelfer, die sogenannten Hitzeschockproteine. Sie kommen bei zellulärem Stress wie erhöhter Temperatur, UV-Strahlung, oder auch bei Krebs zum Einsatz. Hitzeschockproteine helfen anderen Proteinen ihre funktionelle Struktur aufrechtzuerhalten und geschädigte Proteine abzubauen. So wird der zellulären Ausnahmesituation entgegengewirkt.
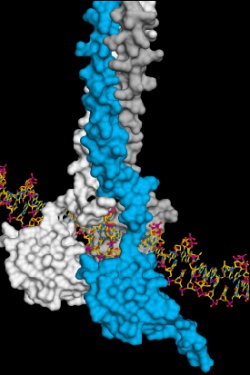
Wie der Mitarbeiter einer Einsatzzentrale, fungiert in den Zellen HSF1, der Hitzeschock-Transkriptionsfaktor 1. Es bindet an bestimmte DNA-Sequenzen, die die Bauanleitungen der zellulären Helfer kodieren. Durch die Aktivierung von HSF1 wird die Produktion der funktionellen Hitzeschockproteine angeworfen.
Wie HSF1 genau an die DNA bindet hat jetzt Andreas Bracher zusammen mit seinem Team in der Abteilung für Zelluläre Biochemie von Professor Hartl am Max-Planck-Institut für Biochemie in Martinsried gezeigt. „Mittels der Röntgenstrukturanalyse haben wir die exakte Anordnung der Moleküle untersucht“, erklärt Tobias Neudegger aus Brachers Team und Erstautor der Studie. Proteine bestehen aus langen Ketten von Aminosäuren die eine bestimmte dreidimensionale Struktur annehmen um funktionell aktiv zu sein.
„Wir konnten zeigen, wie sich beim zellulären Stress drei identische HSF1-Moleküle zusammenlagern. Erst so entsteht eine stabile DNA-HSF1-Verbindung. Ist HSF1 nicht an DNA gebunden, liegt jedes einzelne HSF1-Molekül in einem inaktiven Zustand in der Zelle vor“, erklärt Neudegger weiter.
Auch für die Behandlung von Krankheiten kann die vermehrte Produktion von Hitzeschock-proteinen von Vorteil sein. „Da wir jetzt die Struktur von HSF1 kennen, können Medikamente entwickelt werden, die HSF1 aktivieren oder deaktivieren und so die zellulären Helfer herstellen oder deren Herstellung hemmen“, erklärt Bracher die zukünftige Richtung der HSF1-Forschung. So könnten falsch gefaltete Proteine in den Zellen repariert werden oder kaputte Proteine besser abgebaut werden. Fehlgefaltete Proteine gibt es vor allem in der Huntingtonkrankheit, Alzheimer und Parkinson, sowie auch in Krebszellen.
Originalpublikation:
T. Neudegger, J. Verghese, M. Hayer-Hartl, F. U. Hartl & A. Bracher: Structure of human heat-shock transcription factor 1 in complex with DNA. Nature Structural & Molecular Biology, Februar 2016
DOI: 10.1038/nsmb.3149
Quelle: Max-Planck-Institut für Biochemie
02.03.2016