Bildquelle: National Cancer institute/Dr. Lance Liotta Laboratory (CC 0)
News • Seltene Tumorerkrankung bei Kindern
Ewing-Sarkom: Experimentelle Fortschritte bei zielgerichteter Therapie
Ewing-Sarkome werden zwar zu den seltenen Erkrankungen gezählt, sind jedoch mit einer Häufigkeit von 2-2,4 von 1.000.000 die zweithäufigsten Knochentumoren bei Kindern und jungen Erwachsenen.
Obwohl sich das Gesamtüberleben für 70 Prozent der Erkrankten in den letzten Jahren durch Kombinationen von Operation, Bestrahlung und Chemotherapie stark verbessert hat, verstirbt etwa ein Drittel der Patienten mit Metastasen innerhalb der ersten fünf Jahre nach Diagnose. Leider gibt es gerade für seltene Erkrankungen von Seiten der pharmazeutischen Industrie oft nur wenig wirtschaftlichen Anreiz zur Entwicklung von wirksamen und möglichst zielgerichteten Therapien. Daher haben sich die Forscher Prof. Dr. Wolfgang Berdel und Dr. Sebastian Bäumer von der Westfälischen Universität (WWU) Münster in diesem Projekt vorgenommen, eine solche Therapie zu entwickeln. Im Fachjournal Oncogene berichten die Wissenschaftler, welche Fortschritte sie dabei bislang gemacht haben.
Ursache für das Wachstum ist eine genetische Veränderung, die die Bildung eines sogenannten Fusionsproteins EWS-FLI1 hervorruft. Dieser neue Faktor verändert die Zellen so, dass sie ungehemmt wachsen. Im Labor konnte bereits dieser Faktor und damit das Wachstum der Ewing-Tumorzellen gehemmt werden. Im Patienten gelang dies bislang nicht, der Faktor EWS-FLI1 galt als „unangreifbar“.
2005 ging der Nobelpreis für Medizin an die beiden Forscher Craig Mello und Andrew Z. Fire für ihre Entdeckung, dass kleine RNA-Moleküle die Vorlage von jeglichen Proteinen in der Zelle, die sogenannte mRNA, hemmen können. In die Anwendung dieser sogenannten small interfering RNAs (siRNAs) wurde und wird große Hoffnung gesetzt, da mit ihnen solche bislang unangreifbare Faktoren wie EWS-FLI1 aus den Ewing-Tumorzellen stillgelegt werden könnten. Weil siRNAs aber nicht spontan von Zellen aufgenommen und darüber hinaus rasch in der Blutzirkulation abgebaut werden, suchen viele Forschungsgruppen seither mit Hochdruck nach einer Lösung, wie sich siRNAs sicher und effektiv in Zellen transportieren lassen.
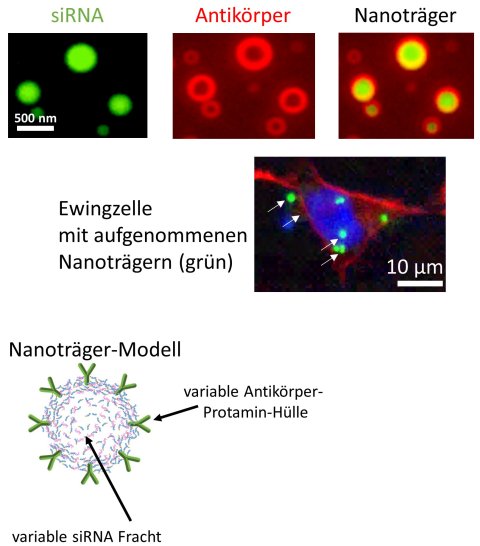
© WWU / Sebastian Bäumer
Um die siRNA vor einem unerwünschten Abbau in der Blutzirkulation zu schützen, wurde sie in einen Nanoträger aus Protamin, einem körpereigenen Spermiumprotein, verpackt. Zudem umgaben die beiden Forscher aus Münster diese Nanoträger mit Antikörpern gegen ein Oberflächenmolekül von Ewing-Tumorzellen. So können sich die Antikörper mitsamt dem Protamin und den siRNAs gegen das EWS-FLI1 an die Einwegzelle binden und sogar aufgenommen werden. Innerhalb der Zelle verhindern die siRNAs dann die Produktion von EWS-FLI1 und entziehen so den Ewing-Tumorzellen die Grundlage für ihr ungehemmtes Wachstum. Mit Hilfe von Mäusen konnte die Forschungsgruppe bereits nachweisen, dass das Wachstum von Ewing-Tumorzellen nach Injektion mit dem Nanoträger samt Fracht stark eingeschränkt wurde, ohne dass die Mäuse dabei Anzeichen von Nebenwirkungen hatten. So kann davon ausgegangen werden, dass sich die Wirkung der siRNAs gegen EWS-FLI1 wie erhofft und erwartet auf die Ewing-Sarkomzellen beschränkt. Dies ist ein bedeutsamer Unterschied zu sonstigen Chemotherapeutika, die prinzipiell in alle Körperzellen aufgenommen werden können. EWS-FLI1 befindet sich nur in den Ewing-Tumorzellen und nur diese Zellen sind von seiner Anwesenheit abhängig. Damit kann die siRNA gegen EWS-FLI1 auch bei unbeabsichtigter Aufnahme in Nicht-Ewing-Tumorzellen voraussichtlich keinen Schaden anrichten und wird schnell vom Körper abgebaut.
Der Forschungsgruppe gelang es, ihre Ergebnisse durch Anpassung der siRNA und des Antikörpers auf andere Krebsarten wie Lungen- oder Blutkrebs auszuweiten. Die RNA-Interferenz kann nun therapeutisch angewendet werden, indem das System modular auf die Bedürfnisse anderer Tumorerkrankungen oder gänzlich anderer Erkrankungen übertragen wird. So ist eine Plattform für die Entwicklung weiterer molekularer und personalisierter Therapieoptionen entstanden.
Quelle: Wilhelm Sander-Stiftung
06.05.2022