News • Präzisionsonkologie
Erste EU-Medikamentenzulassung mit tumor-unabhängiger Indikation
Bayer hat vom Ausschuss für Humanarzneimittel (CHMP, Committee for Medicinal Products for Human Use) die Empfehlung zur Zulassung für das präzisionsonkologische Medikament Larotrectinib in der Europäischen Union erhalten.
Die Empfehlung bezieht sich auf die Behandlung von erwachsenen und pädiatrischen Patienten mit soliden Tumoren, die eine NTRK-Genfusion (neurotrophe Tyrosin-Rezeptor-Kinase) aufweisen, und bei denen die Tumore lokal fortgeschritten oder metastasiert sind oder bei denen eine chirurgische Resektion wahrscheinlich eine hohe Morbidität zur Folge haben wird, und für die keine zufriedenstellenden Therapieoptionen zur Verfügung stehen. Die endgültige Entscheidung der Europäischen Kommission wird in den kommenden Monaten erwartet. Larotrectinib ist ein neuartiger oral einzunehmender TRK-Inhibitor, der gezielt zur Behandlung von Tumoren mit einer NTRK-Genfusion entwickelt wurde. Es wäre das erste Medikament in der EU mit einer tumor-unabhängigen Indikation. Das Produkt ist bereits in den USA sowie in Brasilien und Kanada zugelassen.
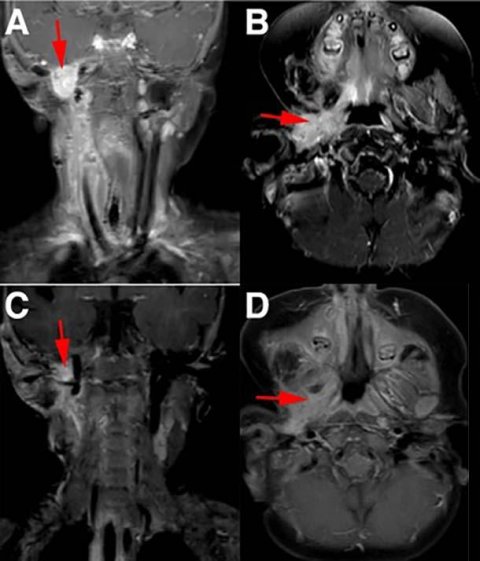
Credit: Pediatr Blood Cancer. Aug. 2016. doi: 10.1002/pbc.26026. CC BY 4.0
Die Zulassungsempfehlung des CHMP beruht auf gepoolten Daten aus klinischen Studien von insgesamt 102 Patienten (93 aus der primären Analyse sowie 9 weiteren mit primären Tumoren des zentralen Nervensystems, ZNS). In diesen Studien (Phase-I-Studie an Erwachsenen, NCT02122913; Phase-I/II-Studie SCOUT an Kindern und Jugendlichen, NCT02637687; und Phase-II-Basket-Studie NAVIGATE an Jugendlichen und Erwachsenen, NCT02576431) zeigte Larotrectinib eine hohe Ansprechrate, wobei das Ansprechen frühzeitig auftrat und lang anhaltend war. Die Ergebnisse der Primäranalyse (n=93) zeigen eine Gesamtansprechrate (overall response rate, ORR) von 72% (95% CI: 62, 81%), darunter 16% vollständiges Ansprechen (complete response, CR) und 55% partielles Ansprechen (partial response, PR). In der zusätzlichen Analyse, die die Patienten mit primären ZNS-Tumoren beinhaltete (n=102), lag die ORR bei 67% (95% CI: 57, 76%), davon 15% CR und 51% PR. Zum Zeitpunkt der primären Datenanalyse war die mediane Dauer des Ansprechens noch nicht erreicht worden, wobei die Ansprechdauer zwischen mehr als 1,6 und mehr als 38,7 Monaten lag. Bei 75% der Patienten, die auf das Medikament ansprachen, dauerte das Ansprechen 12 Monate oder länger an. 88 Prozent (95% CI: 81, 95) der behandelten Patienten lebten noch ein Jahr nach dem Beginn der Behandlung. Die mediane Zeit bis zum Fortschreiten der Erkrankung bzw. zum Tod (medianes progressions-freies Überleben, PFS) war zum Zeitpunkt der Datenanalyse ebenfalls noch nicht erreicht.
Die Mehrzahl der Unerwünschten Ereignisse (UEs) waren vom Grad 1 oder 2; Grad 4 war der höchste gemeldete Grad für die Nebenwirkungen und umfasste eine erniedrigte Neutrophilenzahl (1,6%) und erhöhte ALT (< 1%). Für die Nebenwirkungen Anämie, Gewichtszunahme, Fatigue, erhöhte AST, Schwindelgefühl, Parästhesie, Übelkeit, Myalgie und erniedrigte Leukozytenzahl war Grad 3 der höchste gemeldete Grad. Alle gemeldeten Nebenwirkungen vom Grad 3 traten bei weniger als 5% der Patienten auf, ausgenommen Anämie (7%). Drei Prozent der Patienten mussten die Behandlung aufgrund von therapiebedingter UEs abbrechen. Von insgesamt 125 in die Sicherheitsanalyse einbezogenen Patienten wurde bei 19 (15%) die Dosis reduziert, bei 10 davon (8%) aufgrund von UEs. Die Mehrzahl der UEs, die zu einer Reduzierung der Dosis führten, traten innerhalb der ersten drei Monate der Behandlung auf.
Obwohl TRK-Fusionstumore insgesamt selten sind - basierend auf epidemiologischen Daten aus verschiedenen Ländern schätzt man die Gesamtzahl auf nicht mehr als einige Tausend Fälle in ganz Europa pro Jahr - können sowohl Kinder als auch Erwachsene davon betroffen sein. TRK-Fusionstumore können überall im Körper auftreten, da die zugrundeliegenden NTRK-Genfusionen unabhängig von bestimmten Zell- oder Gewebearten auftreten können. In klinischen Studien wurde Larotrectinib in 29 verschiedenen Histologien untersucht, darunter Lungen- und Schilddrüsenkrebs, Melanom, gastrointestinale Tumore wie Dickdarm-, Bauchspeicheldrüsenkrebs, Gallengangskarzinome oder Karzinome des Wurmfortsatzes, Sarkome, Tumore des zentralen Nervensystems (Gliome und Glioblastome), sekretorische Speicheldrüsenkarzinome sowie bestimmte pädiatrische Krebserkrankungen (z.B. Infantiles Fibrosarkom, Weichteilsarkome). Larotrectinib ist ein oral einzunehmender, hoch-selektiver TRK-Inhibitor, der die durch die NTRK-Genfusion anomalen und kontinuierlich aktiven TRK-Fusionsproteine hemmt. In Studien zeigte der Wirkstoff Wirksamkeit bei Patienten mit TRK-Fusionstumoren unabhängig von Tumortyp und Alter, auch bei Patienten mit Hirnmetastasen oder primären ZNS-Tumoren. ZNS-Tumore oder Hirnmetastasen sind aufgrund der Blut-Hirn-Schranke schwer zu behandeln.
Je mehr die Wissenschaft über die molekulare Aufklärung eines Tumors und die Zusammenhänge versteht, desto wichtiger wird es, diese Testungen breiter durchzuführen
Scott Z Fields
"Die Zulassungsempfehlung für Larotrectinib in der EU mit der ersten tumor-unabhängigen Indikation ist ein bedeutender Schritt, um dieses neuartige Präzisionsmedikament, welches das erste in dieser Art überhaupt darstellt, für Kinder und Erwachsene mit TRK-Fusionstumoren in Europa verfügbar zu machen", sagte Dr. Scott Z Fields, Leiter der Onkologie-Entwicklung bei Bayer. "Larotrectinib ist speziell entwickelt worden, um Patienten mit TRK-Fusionstumoren zu behandeln. Es hat das Potenzial, die Behandlungsergebnisse für diese Patienten bedeutend zu verbessern, unabhängig vom Alter der Patienten oder Ort der Tumor-Entstehung im Körper. Je mehr die Wissenschaft über die molekulare Aufklärung eines Tumors und die Zusammenhänge versteht, desto wichtiger wird es, diese Testungen breiter durchzuführen. So wird ermöglicht, in Frage kommende Patienten, die von einer präzisionsonkologischen Therapie profitieren könnten, zu identifizieren und zu behandeln."
TRK-Fusionstumore lassen sich durch Identifizierung von NTRK-Genfusionen mithilfe spezieller Tests diagnostizieren, darunter Verfahren des Next Generation Sequencing (NGS, Sequenzierungstechnologie der nächsten Generation). NGS ist eine Testmethode zur Detektion einer großen Anzahl von Genveränderungen bei minimalem Gewebebedarf. Fluoreszenz-in-situ-Hybridisierung (FISH) und Polymerase-Kettenreaktion (PCR)-basierte Tests hingegen sind aufgrund der geringeren Multiplex-Fähigkeiten eher für sehr gezielte Analysen geeignet, während Immunohistochemie (IHC) auf dem Nachweis des TRK-Proteins basiert.
Quelle: Bayer
29.07.2019