Nanomedizinisches Therapiekonzept
Die Anti-Tumor-Synergie
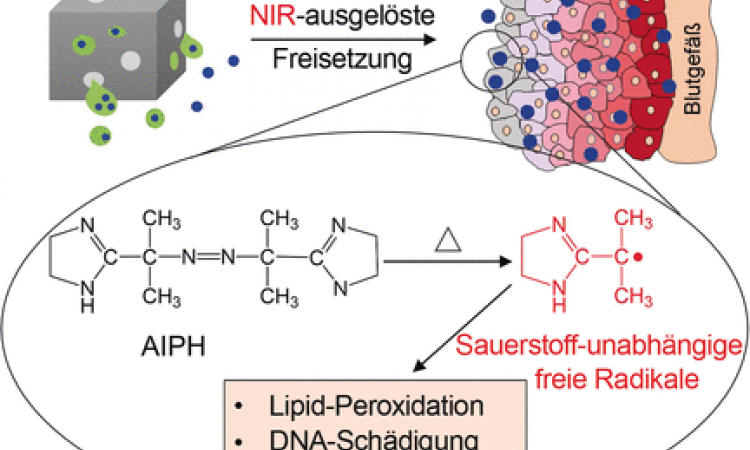
Biokompatible Nano-Kapseln, beladen mit einer Aminosäure und bestückt mit einem Enzym, vereinen jetzt zwei Anti-Tumor-Strategien zu einem synergistischen Therapiekonzept, von dem sich Forscher eine stärkere Wirkung bei minimierten Nebenwirkungen erhoffen. Das Wirkprinzip: Tumorzellen wird ihr Nährstoff Glucose entzogen, indem er in toxisch wirkendes Stickstoffmonoxid (NO) und Wasserstoffperoxid (H2O2) umgesetzt wird.
NO ist ein Giftgas und verursacht Smog. Einerseits. In niedrigen Konzentrationen ist es andererseits ein wichtiger körpereigener Botenstoff, der z.B. Kreislauf und Libido reguliert, sowie eine physiologische Abwehrwaffe gegen Pilze und Bakterien. In höherer Konzentration ist NO in der Lage, Tumorzellen abzutöten und zudem die Wirksamkeit von Photo- und Radiotherapien zu steigern. Für einen klinischen Einsatz sollte NO aber erst am Zielort aus einer biokompatiblen Vorstufe freigesetzt werden.
Die natürliche Aminosäure L-Arginin (L-Arg) kommt hierfür in Frage, da das körpereigene Enzym induzierbare NO-Synthase (iNOS) NO aus L-Arg bildet. NO entsteht ebenfalls, wenn L-Arg durch H2O2 oxidiert wird. Dies ist interessant, da die Mikroumgebung von Tumoren reich an H2O2 ist. Diesen Ansatz für eine NO-Gastherapie verfolgen die Forscher von der Shenzhen University (China), den National Institutes of Health (Bethesda, USA) sowie der University of Maryland (College Park, USA). Der besondere Clou: Sie kombinierten ihn mit einem Ansatz zum Aushungern von Krebszellen zu einem synergistischen Konzept.
Statt Tumore durch Veröden der versorgenden Blutgefäße auszuhungern wollen sie die als Nährstoff benötigte Glucose innerhalb des Tumors durch eine metabolische Reaktion verbrauchen: durch das Enzym Glucose-Oxidase (GOx), das Glucose in Gluconsäure und H2O2 umgesetzt. Ein anderer nützlicher Nebeneffekt sind die erhöhten H2O2-Konzentrationen, die zum einen cytotoxisch sind und zum anderen die Freisetzung von NO aus L-Arg beschleunigen. Weiterer Nebeneffekt: H2O2 und NO reagieren zu hochtoxischen Peroxinitriten, die die Tumorzellen schädigen.
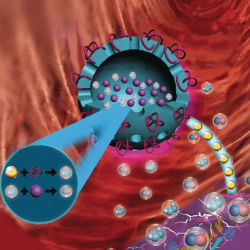
Das Team um Peng Huang, Tianfu Wang und Xiaoyuan Chen hat jetzt einen wichtigen Meilenstein bei der Umsetzung dieses Konzepts erreicht: Sie entwickelten biokompatible, bioabbaubare poröse Nanokapseln aus Organosilikaten, die gleichzeitig GOx und L-Arg in Tumorzellen transportieren. GOx wird auf der Oberfläche gebunden, L-Arg in das Kapselinnere gefüllt. Während das GOx sofort nach Injektion der Nanokapseln in den Tumor aktiv ist, wird das L-Arg zunächst durch die Poren, dann durch den Zerfall der Kapseln nach und nach freigesetzt. Dank ihres großen Hohlraums können die Käpselchen zudem als Ultraschall-Kontrastmittel für die bessere Ortung des Tumors dienen.
Sowohl Versuche mit Zellkulturen als auch mit Mäusen sprechen für einen deutlichen synergetischen Effekt der Kombi-Therapie, die effektiv das Zellwachstum hemmte, Zelltod auslöste und Tumore der Mäuse schrumpfen ließ.
Quelle: Gesellschaft Deutscher Chemiker e.V.
22.12.2016