MINFLUX
Ultimative Auflösungsgrenze in der Fluoreszenzmikroskopie
Forscher um Nobelpreisträger Stefan Hell vom Max-Planck-Institut für biophysikalische Chemie haben mit MINFLUX ein neues Fluoreszenzmikroskop entwickelt, mit dem sich erstmals Moleküle trennen lassen, die nur Nanometer (millionstel Millimeter) voneinander entfernt sind.
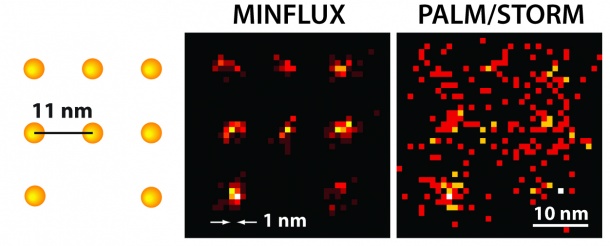
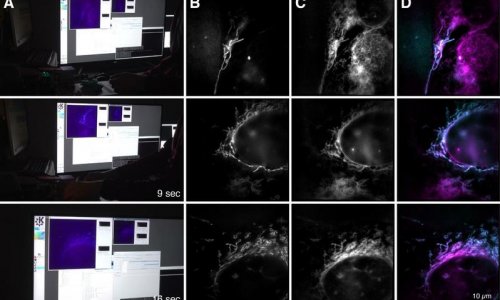
Dieses Mikroskop ist mehr als 100 Mal schärfer als herkömmliche Lichtmikroskopie und übertrifft selbst die bisher besten lichtmikroskopischen Methoden – STED und PALM/STORM – um das bis zu 20-Fache. „Mit MINFLUX erreichen wir Auflösungen von einem Nanometer, das ist der Durchmesser einzelner Moleküle – die ultimative Grenze dessen, was in der Fluoreszenzmikroskopie möglich ist“, erklärt Stefan Hell, Direktor am MPI für biophysikalische Chemie. „Ich bin überzeugt, dass MINFLUX-Mikroskope das Zeug dazu haben, eines der grundlegendsten Werkzeuge der Zellbiologie zu werden. Mit diesem Verfahren wird es in Zukunft möglich sein, Zellen molekular zu kartografieren und schnelle Vorgänge in ihrem Inneren in Echtzeit sichtbar zu machen. Das könnte unser Wissen über die molekularen Abläufe in lebenden Zellen revolutionieren.“
Der Göttinger Physiker war sich schon lange sicher, dass die Fluoreszenzmikroskopie mit ihrer Auflösung in die Dimension einzelner Moleküle vordringen kann – unter klassischer Verwendung von fokussiertem Licht und normalen Objektiven.
Zwar hatte der Physiker Ernst Abbe 1873 formuliert, dass die Auflösung von Lichtmikroskopen auf die halbe Wellenlänge des Lichts begrenzt ist – das sind etwa 200 Nanometer. Und auch mehr als 100 Jahre später behält dieses Abbe-Limit physikalisch seine Gültigkeit. Doch Hell zeigte als Erster mit der von ihm 1994 erdachten und fünf Jahre später experimentell umgesetzten STED-Mikroskopie, dass sich diese Grenze überwinden lässt.
STED und das ein paar Jahre später entwickelte PALM/STORM erreichen in der Praxis eine Trennschärfe von etwa 20 bis 30 Nanometern – rund zehn Mal besser als das Abbe-Limit. Für die Entwicklung dieser ultrahochauflösenden Lichtmikroskopie-Techniken wurden Hell und Betzig gemeinsam mit ihrem Kollegen William E. Moerner im Jahr 2014 mit dem Nobelpreis für Chemie ausgezeichnet.
Stärken von STED und PALM/STORM kombiniert
Sowohl STED als auch PALM/STORM trennen benachbarte fluoreszierende Moleküle, indem sie diese nacheinander an- und ausschalten und so sequenziell zum Leuchten bringen. Die beiden Methoden unterscheiden sich aber in einem wesentlichen Punkt: Die STED-Mikroskopie setzt einen Donut-förmigen Laserstrahl ein, um das Leuchten der Moleküle an genau festgelegten Koordinaten in der Probe zu unterdrücken. Der Vorteil: Durch den definierten Donut-Strahl weiß man präzise, an welchem Punkt im Raum sich das gerade leuchtende Molekül befindet. Der Nachteil: Den Laserstrahl kann man in der Praxis nicht stark genug machen, um nur ein einziges Molekül anzusteuern. Bei PALM/STORM hingegen erfolgt das An- und Ausschalten an zufälligen Orten Molekül für Molekül – mit dem Vorteil, dass man bereits auf der Ebene einzelner Moleküle arbeitet, aber auch dem Nachteil, dass man deren genaue Positionen nicht kennt und erst herausfinden muss. In der Praxis lässt sich so routinemäßig keine molekulare Auflösung erreichen.
Hell hatte die Idee, die Stärken beider Techniken in einem neuen Konzept zu verbinden. „Diese Aufgabe war alles andere als trivial. Aber meine Mitarbeiter Francisco Balzarotti, Yvan Eilers und Klaus Gwosch haben hervorragende Arbeit geleistet und die Idee experimentell mit mir umgesetzt.“ Ihre neue Technik MINFLUX (von englisch minimal emission fluxes, minimale Emissionsflüsse) stellt Hell nun mit den drei Nachwuchswissenschaftlern als Erstautoren im Fachjournal Science vor.
MINFLUX schaltet – wie PALM/STORM – einzelne Moleküle zufällig an und aus. Gleichzeitig bestimmt es aber – wie STED – deren exakte Position mit einem Donut-förmigen Laserstrahl, der im Gegensatz zu STED nicht zum Abregen, sondern zum Anregen der Fluoreszenz benutzt wird. Liegt das Molekül auf dem Donut-Ring, so leuchtet es; liegt es exakt in seinem dunklen Zentrum, so leuchtet es nicht, doch man hat seine genaue Position gefunden. Damit diese Position mit höchster Präzision schnell bestimmt werden kann, entwickelte Balzarotti einen ausgeklügelten Algorithmus. „Mit diesem Algorithmus konnten wir das volle Potenzial des Donut-Laserstrahls ausschöpfen“, erläutert der Nachwuchswissenschaftler. Gwosch, dem die Aufnahme der molekular aufgelösten Bilder gelang, ergänzt: „Es war ein unglaubliches Gefühl, als wir zum ersten Mal mit MINFLUX Moleküle auf der Skala von wenigen Nanometern unterscheiden konnten.“
100 Mal bessere Zeitauflösung
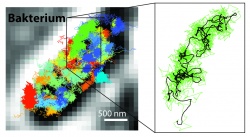
Neben der molekularen Auflösung bietet die Kombination von STED und PALM/STORM einen weiteren großen Vorteil: „MINFLUX ist im Vergleich sehr viel schneller: Da die Technik mit dem Donut-Laserstrahl arbeitet, kommt sie mit wesentlich weniger Lichtsignal, das heißt Fluoreszenz-Photonen, pro Molekül aus als PALM/STORM“, so Hell. Bereits mit STED konnte man Echtzeit-Videos aus dem Inneren lebender Zellen aufnehmen. Doch nun sei es möglich, die Bewegung von Molekülen in einer Zelle mit einer 100 Mal besseren zeitlichen Auflösung zu verfolgen, wie Eilers betont. Er hatte es geschafft, mit MINFLUX die Bewegung von Molekülen in einem lebenden E. coli-Bakterium in bisher unerreichter Zeitauflösung zu „filmen“. „Und bei der Geschwindigkeit haben wir die Möglichkeiten von MINFLUX noch längst nicht ausgereizt“, sagt Eilers. Die Forscher sind überzeugt, dass sich zukünftig selbst extrem schnelle Abläufe in lebenden Zellen untersuchen lassen – etwa die Bewegung zellulärer Nanomaschinen oder die Faltung von Proteinen.
Original-Veröffentlichung:
Balzarotti F, Eilers Y, Gwosch KC, Gynnå AH, Westphal V, Stefani FD, Elf J, Hell SW: Nanometer resolution imaging and tracking of fluorescent molecules with minimal photon fluxes. Science, 22. Dezember 2016.
Quelle: Max-Planck-Institut für biophysikalische Chemie
02.01.2017