Artikel • Medikamentenentwicklung
Unterstützung vom anderen Ende der Welt
Im Kampf gegen resistente Keime haben sich Partner zusammengetan, die kaum weiter voneinander entfernt sein könnten – und doch eine Menge Gemeinsamkeiten haben.
Bericht: Wolfgang Behrends
Im Januar startete das International Consortium for Anti-Infective Research, kurz iCAIR. Auf deutscher Seite sind die Medizinische Hochschule Hannover (MHH) und das Fraunhofer-Institut für Toxikologie und Experimentelle Medizin ITEM beteiligt. Der Dritte im Bunde, das Institute for Glycomics (IfG) der Griffith University, hat seine Heimat in der australischen Stadt Gold Coast – knapp 16.000 Kilometer Luftlinie entfernt. Die enorm große Distanz hält die deutsch-australische Forscher-Kooperation nicht von ihrem Ziel ab: der Entwicklung neuer Wirkstoffe gegen Infektionen. Prof. Dr. Armin Braun, Bereichsleiter Präklinische Pharmakologie und In vitro-Toxikologie am Fraunhofer ITEM, erklärt das besondere Potenzial der weltumspannenden Allianz.

Die Idee hinter iCAIR ist simpel: Wie ineinandergreifende Zahnräder sollen die Partner ihre jeweiligen Stärken kombinieren und so ein Projekt schaffen, das mehr ist als die Summe seiner Teile. So bringt IfG-Direktor Prof. Mark von Itzstein große Expertise bei Entwicklung, Design und Optimierung von Wirkstoffen mit – er war maßgeblich an der Entwicklung von Relenza beteiligt, einem hochwirksamen Medikament gegen Grippeviren. „Was auf seiner Seite allerdings fehlte, war der translationale Aspekt, in dem es um Toxikologie, Qualitätssicherung und das präklinische Proof-of-Concept geht“, sagt Braun. Dieses Know-how steuern nun ITEM und MHH bei.
Wenn die Pharmaindustrie einpackt, packen andere an
Die Politik hat erkannt, dass viel Geld investiert werden muss, um im Fall einer Pandemie Millionen Tote zu vermeiden
Armin Braun
Auch die Finanzierung des Projekts stemmen die drei Partner gemeinsam: Das eigentliche iCAIR-Programm wird von Fraunhofer finanziert, MHH und IfG tragen die Kosten ihrer jeweiligen Projekte selbst. Diese finanzielle Eigenständigkeit ist eine zentrale Säule des Konsortiums, erklärt Braun: „Die Pharmaindustrie hat mittlerweile ihre Möglichkeiten zur Entwicklung von Antiinfektiva weitgehend abgebaut. Denn für sie ist es nicht interessant, in ein neues Reserveantibiotikum zu investieren, das per Definition möglichst selten zum Einsatz kommen soll.“ iCAIR soll dagegen die Entwicklung neuer Wirkstoffe jenseits kommerzieller Interessen ermöglichen. Über eigene Patente soll die Forschung refinanziert werden.
„Es ist keine Alternative, auf die Entwicklung neuer Antiinfektiva zu verzichten, nur weil die Pharmaindustrie kein Geschäftsmodell findet“, betont Braun. Alternative Finanzierungsquellen wie die Gates-Stiftung, öffentliche Geldgeber wie das BMBF oder die genannte iCAIR-Allianz sind in dieser Situation der Weg, um die weltweite Versorgung mit Wirkstoffen zu gewährleisten. „Die Politik hat erkannt, dass viel Geld investiert werden muss, um im Fall einer Pandemie Millionen Tote zu vermeiden.“
Das Konsortium forscht selbst im Schwerpunktbereich Lunge, doch auch externen Partnern sollen die translationalen Möglichkeiten der Kooperation offen stehen: „Die Idee ist, eine Plattform für Biotech-Unternehmen, Universitäten, aber auch große Pharmafirmen zu schaffen, die womöglich eine interessante Substanz, aber keine eigene Entwicklungslinie haben.“
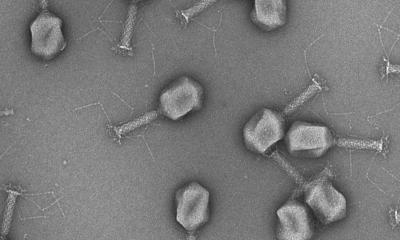
Unterschiedliche Erreger – ähnliche Methoden
Der Bedarf an neuen Antiinfektiva ist groß: Bakterien wie Pseudomonas aeruginosa und Neisseria meningitidis, der Schimmelpilz Aspergillus fumigatus sowie Influenza- und Parainfluenzaviren sind ein wachsendes globales Problem: „Jeder Mensch auf der Welt kann sich mit der Influenza infizieren und der Wandel der Gesellschaftsstruktur vergrößert das Problem: Die Menschen werden immer älter und damit anfälliger für Infektionen.“ Auch die steigende Zahl an organtransplantierten und immunsupprimierten Patienten bietet den Erregern eine wachsende Angriffsfläche. „Gerade gegen Pilzinfektionen gibt es kaum wirksame Medikamente. Deshalb sind die Überlebensraten bei fungalen Ausbrüchen auf Intensivstationen häufig sehr niedrig.“
Trotz großer Unterschiede müssen die iCAIR-Forscher nicht bei jedem Wirkstoff ganz von vorne anfangen: „Die Methoden sind unterschiedlich, aber was Toxikologie, Inhalationswege oder drug delivery in Tier- und Humanmodellen angeht, gibt es universell gültige Ansätze“, erklärt der Toxikologe. Das gesammelte Know-how und einheitliche Qualitätsstandards erleichtern den Zulassungsprozess neuer Substanzen für die präklinische Phase.
Arbeitsteilung spart Jahre an Entwicklungszeit

Die größten Fortschritte kann iCAIR bei der Entwicklung neuer Influenza-Wirkstoffe vorweisen: Dort ist inzwischen die präklinische Proof-of-Concept-Phase erreicht, in etwa zwei bis drei Jahren könnten erste Präparate in der Klinik eingesetzt werden. Nach pharmazeutischen Maßstäben, in denen Entwicklungszyklen durchaus 15 Jahre und länger dauern, ist das ein geradezu schwindelerregendes Tempo. „Das gilt zwar nicht für jeden Wirkstoff, aber in der Regel können wir etwa ein bis drei Jahre einsparen.“
Diese Optimierung wird durch clevere Arbeitsteilung möglich: MHH und IfG konzentrieren sich auf die Identifizierung möglicher drug targets. Auf australischer Seite erfolgt die Selektion und Generierung von Substanzen, aus denen später neue Pharmaka entwickelt werden. „Das geschieht entweder über Computermodelle oder das Screening von Substanzbibliotheken“, erklärt Braun. Die anschließende präklinische Phase samt Wirksamkeitsprüfung ist das Ressort des Fraunhofer ITEM, die auch die weitere klinische Entwicklung und Produktion des Wirkstoffs unterstützt.
Obwohl die Projektpartner an entgegengesetzten Enden der Welt sitzen, funktioniert die Zusammenarbeit hervorragend, beschreibt Braun: „Wir tauschen uns über Videokonferenzen, aber auch persönliche Besuche aus. Da alle Beteiligten Profis sind, die zum Teil jahrzehntelange Erfahrung auf ihren Gebieten haben, macht die Zusammenarbeit viel Spaß.“ Als übergeordnete Strukturen koordinieren advisory board und management board die Arbeitsschritte und setzen Prioritäten. Bereits jetzt sorgt das junge iCAIR-Konsortium für einige Resonanz in der Fachwelt; mehrere Forschungseinrichtungen auf der ganzen Welt haben Interesse bekundet, Teil des Projekts zu werden. Mit dieser zusätzlichen Expertise und den zugehörigen Ressourcen soll langfristig ein weltumspannendes Netzwerk entstehen, in dem gemeinsam neue Antiinfektiva entwickelt werden.
Grippaler Paradigmenwechsel
Derzeitiges Nummer-1-Thema bei iCAIR: Neue Wirkstoffe gegen Influenza. „Sowohl in Deutschland als auch in Australien gab es in jüngerer Vergangenheit massive Probleme mit Grippewellen, weil die Impfstoffe nicht richtig wirken“, sagt Braun. Mittlerweile hat jedoch ein Paradigmenwechsel stattgefunden, der Besserung verheißt: „Man bekämpft den Erreger nicht mehr direkt, sondern setzt an den Eintrittspforten der Viren in die Zellen an.“ Aufhalten kann man die Viren so zwar nicht, aber ihre Effizienz wird herabgesetzt, was den Krankheitsverlauf zumindest abmildert. „Wir geben dem Immunsystem durch unseren Wirkstoff mehr Zeit, auf die Bedrohung zu reagieren“; beschreibt Braun.
Die Effektivität dieser und anderer Methoden testen die Forscher an Humangewebe, das aus Gewebeschnitten gewonnen wird, zum Beispiel aus gesunden Teilen von Tumorresektaten. „Das ist für uns ein völlig neuer Ansatz“, sagt Braun. Im Gegensatz zum Mausmodell entspricht die Reaktion des Gewebes auf Erreger und Wirkstoffe viel genauer dem menschlichen Immunverhalten. Die Gewebeprobe wird mit den Viren infiziert und über mehrere Wochen lebendig gehalten, um die Interaktion zwischen Gewebe und Erreger zu beobachten. „Man sieht unter dem Mikroskop, wie der Virus in die Zellen eindringt und wie sich Zytokine entwickeln – das ist ein Modell, das der tatsächlich im menschlichen Körper stattfindenden Reaktion schon sehr nahe kommt."
Profil:
Prof. Dr. Armin Braun ist Bereichsleiter Präklinische Pharmakologie und In-vitro-Toxikologie am Fraunhofer-Institut für Toxikologie und Experimentelle Medizin ITEM in Hannover. An der Medizinischen Hochschule Hannover (MHH) ist er als Professor für die Immunologie des Respirationstrakts tätig. Braun ist Mitglied des Deutschen Zentrums für Lungenforschung (DZL), sein Forschungsschwerpunkt liegt in der präklinischen Entwicklung von Wirkstoffen gegen Atemwegserkrankungen. Dabei setzt er innovative Verfahren wie lebende Gewebeschnitte (Precision -Cut Lung Slices; PCLS) ein. Braun hat an mehr als 150 wissenschaftlichen Artikeln in internationalen wissenschaftlichen Zeitschriften mitgewirkt.
16.02.2018