
© Oliver Dietze
News • Heilung von Frakturen
Robotisches Implantat erleichtert Reha nach Knochenbruch
Eine neue Generation intelligenter Implantate soll direkt am Knochen überwachen, ob Schienbeinbrüche heilen. Bei Bedarf sollen sie den Heilungsprozess über gezielte Bewegung direkt an der Bruchstelle aktiv anregen.
Hieran arbeitet ein Forschungsteam aus Medizin, Ingenieurwissenschaft und Informatik. Das Team um Bergita Ganse und Tim Pohlemann hat erstmals das nötige bekannte Wissen zusammengetragen, wie Knochenbrüche am besten stimuliert werden, um das beste Heilungsergebnis zu erzielen.
Das Team stellt das Konzept der aktiven Implantate im Fachjournal Acta Biomaterialia vor.
Dass der Knochen trotz Implantat nicht zusammenwächst, ist beim Schienbeinbruch eine relativ häufige Komplikation. Von einhundert Patientinnen und Patienten trifft dies etwa vierzehn
Bergita Ganse
Jeder Unterschenkelbruch ist anders. Ob Motorradunfall oder Grätsche beim Fußball – je nachdem, welche Kräfte auf den Knochen einwirkten, ist das Schadensbild verschieden: von großen Bruchstücken bis hin zu kleinteiligen Knochentrümmern. Entsprechend individuell verheilt auch jeder Bruch. Könnte man im Zeitraffer dem Knochen beim Heilen zusehen, wären an den Bruchstellen kontinuierliche Veränderungen sichtbar, während sich neues Knochengewebe bildet. Gleichwohl besteht die heute übliche Behandlung darin, ein Implantat in Standardgrößen mit den Knochenstücken zu verschrauben; die aktuellen Implantate sind jedoch rein passiv. Nur in zeitlichen Abständen und mit Verzögerung zeigt sich in Röntgenbildern, wie die Heilung verläuft.
„Dass der Knochen trotz Implantat nicht zusammenwächst, ist beim Schienbeinbruch eine relativ häufige Komplikation. Von einhundert Patientinnen und Patienten trifft dies etwa vierzehn“, sagt Professorin Bergita Ganse. „Es ist heute schwierig, die Verzögerung bei der Frakturheilung frühzeitig von außen zu erkennen, um eingreifen zu können. Dies bedeutet für die Betroffenen langwierige Behandlung und für das Gesundheitssystem sehr hohe Kosten“, erläutert die Unfallchirurgin und Inhaberin der Werner Siemens-Stiftungsprofessur für innovative Implantatentwicklung, die an der Universität des Saarlandes das Projekt „Smarte Implantate“ koordiniert. Im interdisziplinären Team entwickeln hier Mediziner, Ingenieure und Informatiker ein für jeden Patienten individuell auf den Knochen maßgeschneidertes Implantat, das ab der Operation direkt vor Ort im Körper Informationen liefert, wie gut oder schlecht ein Bruch verheilt und auch bei Fehlbelastungen warnen kann. Und: Bei Bedarf soll das Implantat selbst die Knochenheilung aktiv fördern. Ein Prototyp des smarten Implantats soll 2025 vorliegen.
Bildquelle: Ganse et al., Acta Biomaterialia 2022 (CC BY-NC-ND 4.0)
Die Forscher kombinieren hierzu modernste Materialtechnik, künstliche Intelligenz und medizinisches Know-how. „Wir wollen mit dieser neuen Klasse von Implantaten die Bruchsteifigkeit und Bruchverschiebung permanent direkt an der Bruchstelle überwachen. Zeigen sich hierbei Probleme, soll das Implantat selbst aktiv gegensteuern, indem es sich bewegt oder versteift und zwar ohne, dass hierzu weitere Eingriffe nötig sind“, erklärt Bergita Ganse. In zahlreichen Vorstudien hat das Forschungsteam der Universität des Saarlandes unter anderem bereits herausgefunden, dass Frakturen schneller heilen, wenn die Bruchstelle durch Mikrobewegungen stimuliert wird.
In vielen Bereichen betreten die Forscher hierbei Neuland. Um das Implantat so zu entwickeln, dass es die Heilung auf die Patienten zugeschnitten optimal unterstützt, müssen zahlreiche komplexe Details und Zusammenhänge geklärt werden. „Bislang ist etwa noch nicht definiert, welche Kräfte, Frequenzen, Kraftrichtungen, Zeitdauern und Zeitperioden oder andere Stimuli solche Implantate idealerweise liefern sollten, um das beste Heilungsergebnis zu erzielen“, erläutert Bergita Ganse. Deshalb hat sie gemeinsam mit ihrem Forschungsteam das bislang bekannte Wissen aus diesem Themenkreis zusammengetragen, mögliche Mechanismen aktiver Implantate erörtert und aufgezeigt, wo weitere Forschung erforderlich ist, um ein aktives Implantat zu entwickeln, das die ideale Unterstützung bietet. Bei den in Acta Biomaterialia veröffentlichten Ergebnissen handele sich um ein Grundlagenpaper, also die erste Übersichtsarbeit überhaupt, die zu diesem Thema bisher weltweit erschienen ist, erklärt Bergita Ganse, die als Koordinatorin auch ihre Erfahrung als Weltraummedizinerin einbringt. Sie forschte in Projekten mit der europäischen Weltraumorganisation ESA und der US-amerikanischen Raumfahrtbehörde NASA unter anderem daran, wie sich Knochen und Muskeln im All abbauen und half dabei, für Astronauten Trainingsmethoden zu entwickeln, um dies zu verhindern.
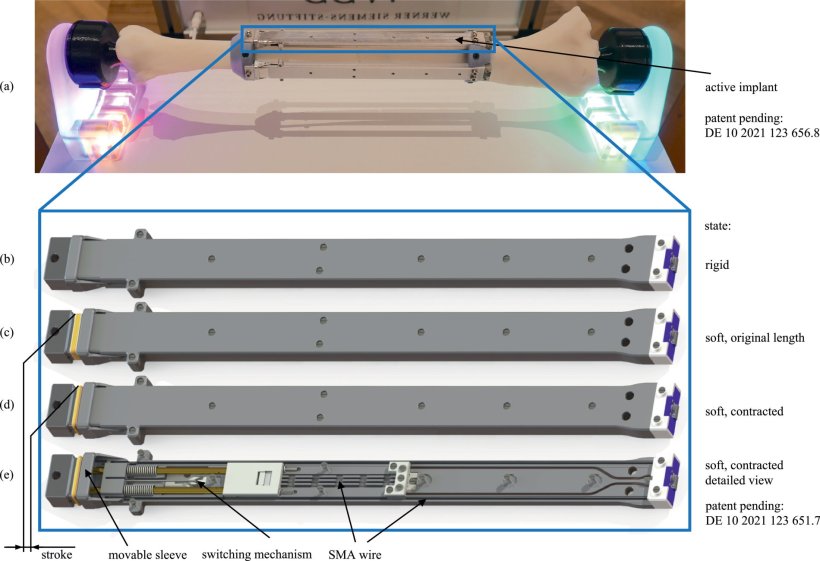
Eine der grundlegenden Neuentwicklungen ist der Einsatz von Formgedächtnisdrähten im Implantat. Im rechten Moment sollen sie die richtige „Krankengymnastik“ übernehmen. Hierzu bedarf es zahlreicher Daten und Informationen. Die haarfeinen Drähte mit Formgedächtnis bestehen aus Nickel-Titan. Hieran forschen an der Universität des Saarlandes die Spezialisten für intelligente Materialsysteme um Professor Stefan Seelecke. Eingebaut im Implantat sollen die Drähte mithilfe elektrischer Signale zum einen als Sensor den Heilungsprozess sichtbar machen, zum anderen die Heilung durch Bewegung stimulieren.
Die Formgedächtnisdrähte nehmen ihre ursprüngliche Form wieder an, wenn sie verformt oder gezogen werden, und können ähnlich wie Muskeln an- und wieder entspannen. Auf kleinem Raum erreichen sie hohe Zugkraft; sie haben die höchste Energiedichte aller bekannten Antriebsmechanismen. Betrieben werden sie mit elektrischem Strom. Jeder Länge der Drähte lässt sich ein exakter Messwert des elektrischen Widerstands zuordnen. Sind die Drähte im Implantat eingebaut, lassen sich selbst kleinste Veränderungen im Frakturspalt in den Messwerten ablesen. Das macht diese künstlichen Muskeln zu Sensoren im Implantat. Zugleich entspricht eine Abfolge solcher Messwerte einem Bewegungsablauf. Mithilfe der Zahlenkolonnen und intelligenten Algorithmen lassen sich Bewegungsabläufe vorausberechnen, programmieren und die Drähte entsprechend automatisiert ansteuern. So könnte das Implantat sich ohne Weiteres direkt am Frakturspalt bewegen und die Heilung durch aktives Verkürzen und Verlängern, durch Aussenden von Impulsen, Wellen oder elektromagnetischen Feldern stimulieren.
Aktuell arbeiten die Forscher an der Feinjustierung und den Details, um diese Muskeln für den Einsatz im Implantat fit zu machen.
Quelle: Universität des Saarlandes
05.07.2022





