Artikel • ZNS-Tumoren
Radiochirurgische Therapie rezidiverender, vortherapierter Glioblastome
Autor: Dr. med. Sebastian Exner, Strahlenzentrum Hamburg

Hochgradige Gliome sind nach der Weltgesundheitsorganisation definiert als Grad III- und IV-Tumore und stellen die häufigsten malignen Tumore des primären Zentralnervensystems bei Erwachsenen dar [2]. Bei neu diagnostizierten Patienten umfasst die Standard-Therapie einen multimodalen Ansatz mit maximal sicherer Resektion, gefolgt von einer adjuvanten Radio-Chemotherapie nach dem Stupp-Protokoll [60 Gy mit simultaner Gabe von Temozolamid (TMZ)], gefolgt von 6–12 TMZ-Zyklen [3]. Trotz dieses Behandlungsstandards beträgt das mediane Überleben nur zwischen 9,3 und 14,6 Monaten beim Glioblastom (GBM) [3].
Die Zeitspanne bis zum Rezidiv entscheidet über die weiteren Therapieoptionen. Viele Zentren bieten Patienten mit rezidivierenden Gliomen eine zweite Operation an. Der operative Eingriff erreicht meist eine Linderung der Symptome, kann aber je nach Lokalisation auch bleibende Schäden mit massiven Einbußen an Lebensqualität zur Folge haben. Eine Alternative stellt hier die Radiochirurgie dar.
Eine geeignete Auswahl der Patienten für eine erneute Strahlentherapie sollte auf Prognosefaktoren basieren, die sich in verschiedenen Bestrahlungsserien als wichtig erwiesen haben: Karnosky-Index, Recursive Partitioning Analysis (RPA)-Einteilung, Größe des Rezidivtumors und zeitlicher Abstand von der Primärtherapie bis zum Rezidiv [4]. Andererseits sollten in individuelle Therapieoptionen nicht nur rigide Faktoren und Scores einfließen, da gerade maligne Hirntumore ein sehr heterogenes Erscheinungsbild zeigen.
Ein wesentlicher Bestandteil der Indikationsstellung zur Radiotherapie ist die zu erwartende Nebenwirkungsrate einer zweiten Bestrahlung. In den meisten Fällen ist die Überlappung des Ziels mit dem zuvor bestrahlten Gewebe von erheblichem Ausmaß, da der Rückfall von GBM typischerweise im Feld oder am Rande des Feldes der primären Radiotherapie auftritt [5].
Die Nebenwirkung einer Radionekrose wird häufig berichtet: Die Rate liegt zwischen 4% [6] und 31,3% [7], je nach publizierter Arbeit. Nicht in allen Studien wird deutlich, ob diese radiologische Nebenwirkung mit Symptomen verbunden ist oder nicht. Auch über den Einsatz von Steroiden bei diesen Patienten wird nicht in allen Arbeiten berichtet.
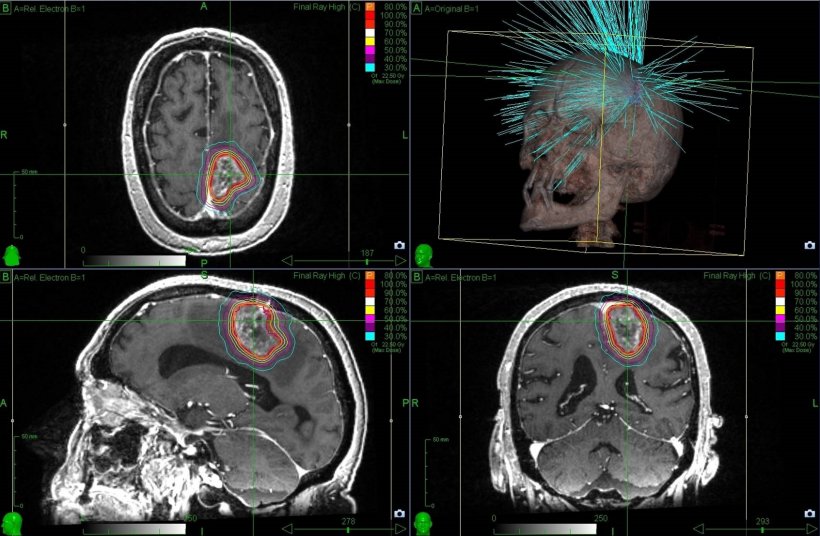
Häufig wird das zu bestrahlende Rezidiv-Tumorvolumen (Gross Tumor Volume (GTV)) als kontrastmittel-anreichernde Läsion bei der MR-Bildgebung definiert [1, 8, 9]. In wenigen Studien und Fallserien wurden andere bildgebende Verfahren zur Abgrenzung des GTV verwendet: MR-Spektroskopie, perfusionsgewichtete Bildgebung und diffusionsgewichtete Bildgebung [10], 11C-Methionin-Positronenemissionstomographie (MET-PET) [11], 18F-Dihydroxyphenylalanin (DOPA) PET [12] oder 123I-alpha-Methyltyrosin (IMT) Einzelphotonen-Computertomographie (SPECT) [11].
Die mediane Behandlungsdosis lag zwischen 12,2 Gy [13] und 20 Gy [14], wobei das mediane Zielvolumen im Bereich von 6,5 [15] bis 28 ml [14] liegt. Das OS lag zwischen 7,5 [15] und 16 Monaten [16].
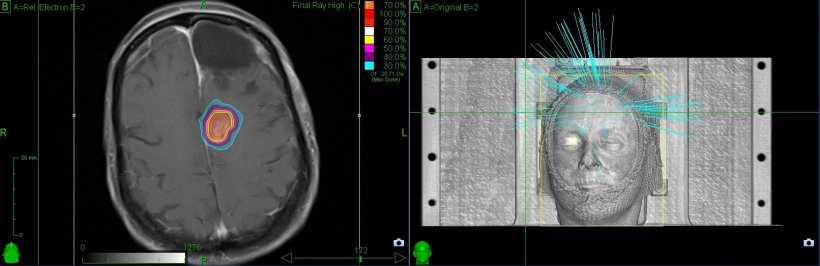
Schlussfolgerung: Klinische Daten zur Bestrahlung von Glioblastom-Patienten legen nahe, dass die Nachbehandlung eines wiederkehrenden Glioms auf jeden einzelnen Patienten zugeschnitten werden muss, um ein relativ gutes Ergebnis mit einem akzeptablen Risiko schwerer Toxizität zu erzielen (<3,5%). Prognose Scores können helfen, geeignete Patienten für eine Re- Bestrahlung zu selektionieren. Jedoch sollten aufgrund des palliativen Gesichtspunkts der Behandlung individuelle Patientenwünsche und die Erfahrung der behandelnden Onkologen Einfluss auf die Indikationsstellung haben. Die Primärbehandlung sollte dem zu erwartenden Rezidiv Rechnung tragen und die Radiotherapie so modulieren, dass eine Re-Bestrahlung noch möglich ist. Zudem erlaubt die moderne Technik, wie beispielsweise das Cyberknife, einen steilen Dosisgradienten zu erzeugen und Lagerungsunsicherheiten zu eliminieren.
Weitere prospektive Studien sind erforderlich, um die vorgeschlagene Strategie weiter zu konsolidieren.
Quellen:
- Adachi, K., et al., Feasibility of Salvage Re-irradiation With Stereotactic Radiotherapy for Recurrent Glioma Using CyberKnife. Anticancer Res, 2019. 39(6): p. 2935-2940.
- Louis, D.N., et al., The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathologica, 2016. 131(6): p. 803-820.
- Stupp, R., et al., Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med, 2005. 352(10): p. 987-96.
- Straube, C., et al., A Second Course of Radiotherapy in Patients with Recurrent Malignant Gliomas: Clinical Data on Re-irradiation, Prognostic Factors, and Usefulness of Digital Biomarkers. Curr Treat Options Oncol, 2019. 20(9): p. 71.
- Rapp, M., et al., Recurrence Pattern Analysis of Primary Glioblastoma. World Neurosurg, 2017. 103: p. 733-740.
- Cho, K.H., et al., Single dose versus fractionated stereotactic radiotherapy for recurrent high-grade gliomas. Int J Radiat Oncol Biol Phys, 1999. 45(5): p. 1133-41.
- Hsieh, P.C., et al., Adjuvant gamma knife stereotactic radiosurgery at the time of tumor progression potentially improves survival for patients with glioblastoma multiforme. Neurosurgery, 2005. 57(4): p. 684-92; discussion 684-92.
- Straube, C., et al., Re-irradiation in elderly patients with glioblastoma: a single institution experience. J Neurooncol, 2019. 142(2): p. 327-335.
- Zemlin, A., et al., Timing of re-irradiation in recurrent high-grade gliomas: a single institution study. J Neurooncol, 2018. 138(3): p. 571-579.
- Conti, A., et al., Efficacy and toxicity of CyberKnife re-irradiation and "dose dense" temozolomide for recurrent gliomas. Acta Neurochir (Wien), 2012. 154(2): p. 203-9.
- Grosu, A.L., et al., Reirradiation of recurrent high-grade gliomas using amino acid PET (SPECT)/CT/MRI image fusion to determine gross tumor volume for stereotactic fractionated radiotherapy. Int J Radiat Oncol Biol Phys, 2005. 63(2): p. 511-9.
- Minniti, G., et al., Fractionated stereotactic reirradiation and concurrent temozolomide in patients with recurrent glioblastoma. J Neurooncol, 2011. 103(3): p. 683-91.
- Skeie, B.S., et al., gamma knife surgery versus reoperation for recurrent glioblastoma multiforme. World Neurosurg, 2012. 78(6): p. 658-69.
- Hall, W.A., et al., Stereotactic radiosurgery for recurrent malignant gliomas. J Clin Oncol, 1995. 13(7): p. 1642-8.
- Martínez-Carrillo, M., et al., Salvage radiosurgery for selected patients with recurrent malignant gliomas. BioMed research international, 2014. 2014: p. 657953-657953.
- Kondziolka, D., et al., Survival Benefit of Stereotactic Radiosurgery for Patients with Malignant Glial Neoplasms. Neurosurgery, 1997. 41(4): p. 776-785.
Profil:
Dr. Sebastian A. Exner ist Facharzt für Strahlentherapie am Strahlenzentrum Hamburg/Cyberknife Center Hamburg. Nach Abschluss seines Medizinstudiums in Düsseldorf war er außerdem an der Klinik für Radioonkologie und Strahlentherapie der Charité Berlin sowie am Onkologischen Therapie Centrum Köln tätig.
29.06.2020