News • Multiresistente Erreger
Neue Antibiotika-Klasse zeigt großes Potenzial gegen MRSA
Die auch als "Krankenhauskeime" bekannten multiresistenten Bakterien stehen zunehmend im Fokus der öffentlichen Aufmerksamkeit. In Kliniken stellen sie eine große Gefahr dar, vor allem für immunsupprimierte Patienten.
Bakterien und Pilze stellen eine sehr gute Quelle für bioaktive Wirkstoffe dar, denn im Wettstreit um limitierte Ressourcen bekämpfen sich Mikroorganismen in der Natur gegenseitig
Roderich Süßmuth
Wissenschaftler der Technischen Universität (TU) Berlin haben jetzt in Zusammenarbeit mit der französischen Firma Deinove eine neue Klasse von Lipopeptid-Antibiotika entdeckt, die vielversprechende Eigenschaften gegenüber multiresistenten Bakterien aufweist. Die Ergebnisse sind in der jüngsten Ausgabe der wissenschaftlichen Fachzeitschrift „Nature Chemical Biology“ veröffentlicht.
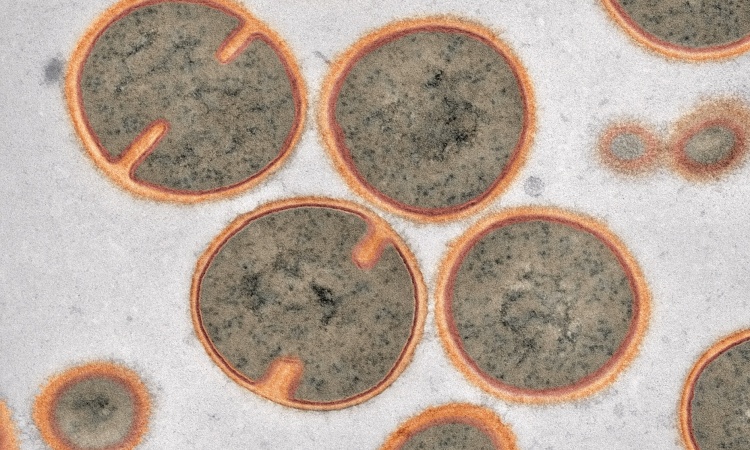
Wie die Arbeitsgruppe von Roderich Süßmuth berichtet, wurde eine Stammsammlung an Bakterien auf die Produktion von antibakteriell wirksamen Molekülen untersucht. Mit Erfolg, denn aus einer Kultur des Bakteriums „Microbacterium arborescens“ konnte eine Verbindung mit starker Aktivität gegen MRSA und andere pathogene Bakterien isoliert werden. „Bakterien und Pilze stellen eine sehr gute Quelle für bioaktive Wirkstoffe dar, denn im Wettstreit um limitierte Ressourcen bekämpfen sich Mikroorganismen in der Natur gegenseitig. Dies können wir uns zunutze machen“, erklärt Roderich Süßmuth.
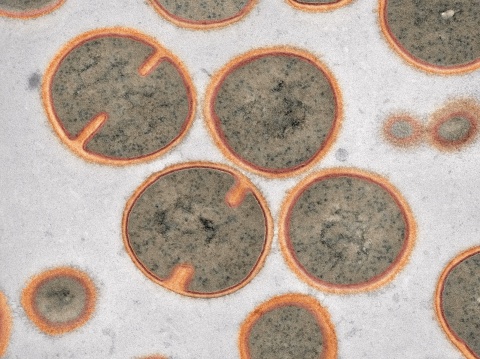
Im Rahmen des Projekts wurde zuerst die chemische Struktur des später Microvionin genannten Moleküls aufgeklärt und die Biosynthese im Labor nachgestellt. Dabei entdeckten die Wissenschaftler Unerwartetes: Microvionin besteht aus einem Peptid- und einem Fettsäureteil, wobei drei der Aminosäuren so modifiziert werden, dass sich zwei Ringstrukturen ausbilden, es also „bizyklisch“ ist. Durch dieses charakteristische Strukturmerkmal mit einer Thioetherbrücke lässt sich Microvionin den sogenannten Lanthipeptiden zuordnen, einer Klasse an ribosomal synthetisierten und posttranslational modifizierten Peptiden (kurz RiPPs). In mehreren Versuchsreihen konnten die Wissenschaftler die Zyklisierung des Moleküls nachvollziehen. Dabei zeigte sich, dass dabei zwei Enzyme eng miteinander kooperieren und so die Bildung von ungewollten Nebenprodukten verhindert wird. „Was uns zusätzlich interessiert, ist die ziemlich ungewöhnliche Fettsäuremodifikation. Hier scheinen zum ersten Mal bei ribosomal synthetisierten Peptiden zwei Biosynthesewege zusammen zu laufen, nämlich ribosomal synthetisierte Peptide und Polyketidsynthasen, deren Zusammenspiel so bisher nicht beobachtet wurde. Das ist für uns natürlich spannend und wird weiterhin intensiv erforscht“, erläutert Süßmuth.
Weitere potenzielle Wirkstoffe entdeckt
Vor allem aufgrund der unerwarteten Struktur und Biosynthese wollten die Wissenschaftler herausfinden, ob es noch weitere ähnliche Verbindungen in der Natur gibt. Bei dem sogenannten „Genome Mining“ werden bakterielle Genome mit dem Ziel analysiert, bestimmte Biosynthese-Gencluster entdecken zu können. Auch hier wurde das Team fündig: Mehr als zehn potenzielle Kandidaten konnten identifiziert werden. Aus einem dieser Stämme wurde mit „Nocavionin“ ein weiteres verwandtes Molekül isoliert. Süßmuth ist zuversichtlich, dass sich die inzwischen „Lipolanthine“ getaufte Gruppe an Antibiotika bald noch weiter vergrößern wird: „Wir versuchen natürlich, nun auch die anderen Moleküle zu isolieren und dann auch Rückschlüsse zwischen der Struktur und Bioaktivität zu ermitteln. Außerdem ist auch die Aufklärung der verbleibenden Schritte der Biosynthese für uns sehr interessant. Zu guter Letzt hoffen wir auch, die Entwicklung von Microvionin zu einem nutzbaren Medikament vorantreiben zu können. Wir stehen bei diesem Projekt ja gerade erst in den Startlöchern und ich bin gespannt, wie es jetzt weitergeht.“
Quelle: Technische Universität Berlin
26.06.2018