Bildquelle: Shutterstock/sfam_photo
News • Maligne Gliome
Mit "Krebs-Impfstoff" und gekaperten Viren gegen bösartige Hirntumoren
Höhergradige Gliome haben nach wie vor keine gute Prognose. Zwei wegweisende klinische Studien mit unterschiedlichen, innovativen immunologischen Therapiekonzepten wurden kürzlich in hochrangigen Fachzeitschriften publiziert.
So wurden in der Neuroonkologie der Universität Heidelberg und Mannheim erstmals über 30 erwachsene Patienten mit einem mutationsspezifischen „Krebsimpfstoff“ behandelt (Publikation in "Nature") und in den USA zeigte eine „onkolytische Virotherapie“ erste Erfolge bei Kindern mit hochmalignen Gliomen (Publikation im "New England Journal of Medicine").
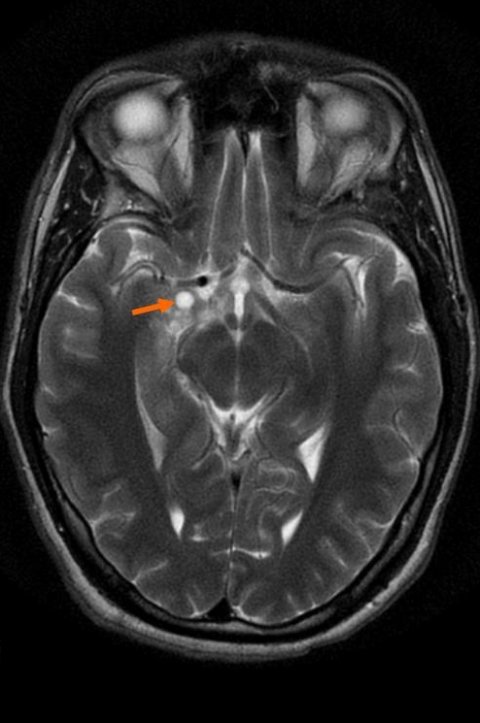
Bildquelle: Blondis, MRI glioma 28 yr old male, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons
Gliome gehören zu den häufigsten Hirntumoren des Erwachsenenalters. Da sie meistens diffus wachsen, ist die chirurgische Therapie oft nicht erfolgreich; insbesondere anaplastische Astrozytome (WHO-Grad III) und Glioblastome (WHO-Grad IV) haben eine schlechte Prognose trotz zusätzlicher Bestrahlung und Chemotherapie. Deutsche Mediziner berichten nun über ein besonders vielversprechendes Konzept bei der Therapie dieser gefürchteten Malignome.
In der Mehrheit der Fälle besitzen Gliomzellen eine bestimmte Genmutation, die zu einer Strukturveränderung („Neo-Epitop“) in einem Protein, dem Enzym Isocitrat-Dehydrogenase 1 (IDH1) führt. Auf der Erkennung tumorspezifischer Neo-Epitope durch das Immunsystem basiert das Prinzip der „Krebsimpfung“, durch die die körpereigene Immunabwehr Tumoren zerstören soll.
Die Forschergruppe der Mediziner Prof. Dr. Michael Platten, Direktor der Neurologischen Klinik und Sprecher des Neuroonkologischen Zentrums Mannheim und Prof. Dr. Wolfgang Wick, Ärztlicher Direktor der Abteilung Neurologie des Universitätsklinikums Heidelberg und Leiter der Klinischen Kooperations einheit Neuroonkologie am DKFZ, hatten in früheren Studien einen IDH1-spezifischen Peptid-Impfstoff (IDH1-vac) entwickelt und damit im IDH1-positiven humanisierten Gliom-Mausmodell erfolgreich eine effektive Immunantwort ausgelöst. Nun wurde diese Vakzine erstmals in einer multizentrischen Phase-I-Studie an 33 Patienten (mittleres Alter 40,4 ± 9 Jahre) mit neudiagnostiziertem, IDH1-positiven Astrozytomen Grad III und IV getestet.
Wir halten die mutationsspezifische Impfung für eine vielversprechende Therapieoption bei malignen Gliomen, die nun in randomisierten, placebokontrollierten Studien überprüft werden muss
Wolfgang Wick
Zusätzlich zur Standardtherapie (Bestrahlung und Chemotherapie mit Temozolomid) erhielten 29 der Patienten alle geplanten acht Impfdosen (in den Wochen 1, 3, 5, 7, 11, 15, 19 und 23). Primäre Studienendpunkte waren das Sicherheitsprofil und die Immunogenität von IDH1-vac. Die subkutane Vakzinierung wurde gut vertragen (Impfstoff-assoziierte Nebenwirkungen maximal Grad 1). Eine spezifische Immunantwort zeigten 93,3% der Patienten. Nach der Nachbeobachtungszeit von drei Jahren lebten noch 84% der Patienten, 63% blieben sogar progressionsfrei, das Tumorwachstum wurde also gestoppt. Bei den Patienten mit nachgewiesener Immunantwort lag die 2-Jahres-Progressionsfreiheit bei 82%. Häufig war bei den Patienten eine Pseudo-Progression zu sehen, also eine Schwellung des Tumorgewebes durch eine entzündliche Immunreaktion. Diese Reaktion ging mit einer erhöhten Zahl immunaktiver T-Helferzellen im Blut der Patienten einher. Bei in dieser Phase reoperierten Patienten zeigte sich eine durch die Impfung ausgelöste spezifische Immunantwort, also insgesamt Zeichen guten Therapieansprechens.
„Die körpereigene Immunabwehr konnte also aktiviert werden“, kommentiert Prof. Wick, Letztautor der Studie. „Wir halten die mutationsspezifische Impfung für eine vielversprechende Therapieoption bei malignen Gliomen, die nun in randomisierten, placebokontrollierten Studien überprüft werden muss.“
Innovativer Therapieansatz bei pädiatrischen Gliomen
Höhergradige maligne Gliome im Kinder- und Jugendalter haben, besonders bei Rezidiven, eine sehr ungünstige Prognose, die mediane Überlebensdauer lag bisher bei ca. sechs Monaten. Die ereignisfreie 3-Jahres-Überlebensrate nach der Erstdiagnosestellung beträgt mit Bestrahlung und Chemotherapie nur 11-22%. Die Möglichkeiten von Immuntherapien sind begrenzt, da diese Malignome meist immunologisch „stumm“ bzw. „kalt“ sind, das heißt, sie besitzen kaum Mutationen beziehungsweise Neo-Antigene als Angriffsziel, entsprechend wandern auch nur wenige Lymphozyten ins Tumorgewebe ein. Aufgrund der Blut-Hirn-Schranke gelangen auch Chemotherapeutika schlecht in das Gewebe.
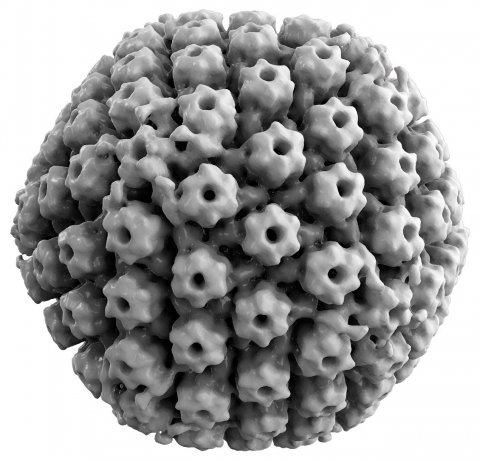
Bildquelle: Thomas Splettstoesser (www.scistyle.com), HSV-1-EM, CC BY-SA 4.0
Bei der sogenannten onkolytischen Virotherapie werden Tumorzellen durch eine gezielte Infektion mit Viren zerstört. Das Herpes simplex Virus Typ I (HSV-1) ist ein bekanntermaßen neurotropes Virus, das besonders leicht in Hirntumorzellen eindringen kann. Forscher aus den USA haben in einer ersten kleinen Studie Kinder mit einem genetisch veränderten HSV-1 „G207“ Virus behandelt. Die G207-Mutation verhindert, dass sich das Virus in gesunden Zellen vermehren kann – die Gliomzellen sind jedoch hochsensibel für HSV-1-G207, es kommt zur Infektion und Lyse der Tumorzellen. Mit einer einzelnen Bestrahlungsdosis kann dieser Effekt im Tiermodell weiter verstärkt werden, da die intrazelluläre Virusreplikation beschleunigt wird.
In der Studie wurde bei 12 Patienten (im Alter von 7-18 Jahren) mit rezidiviertem, hochmalignen Gliom in einem stereotaktischen Eingriff ein Katheter in die Tumorregion implantiert und danach über sechs Stunden eine Infusion mit HSV-1-G207 verabreicht. Eine Gruppe erhielt zusätzlich im Anschluss daran eine Bestrahlung des Tumors mit 5 Gy. Es gab durch die Infusion nur leichte Nebenwirkungen, keine Toxizität oder schweren unerwünschten Ereignisse. Es wurde keine Virusausscheidung im Speichel oder der Tränenflüssigkeit nachgewiesen. In beiden Gruppen (insgesamt bei 11/12 Patienten) kam es zum klinischen, radiologischen oder neurologischen Therapieansprechen; das mediane Überleben lag bei 12 Monaten; 18 Monate nach der G207-Behandlung lebten noch 4/11 Patienten. Im Tumorgewebe kam es zur verstärkten Lymphozyten-Infiltration, „das bedeutet, die G207-Viren haben das immunologisch sonst stumme Tumorgewebe für das körpereigene Immunsystem erkennbar gemacht“, erklärt Prof. Wick.
Beide Studien sollen fortgeführt werden, teilweise kombiniert mit anderen Therapien bzw. als Phase-II-Studie. „Wir sehen hier in der Neurologie/Neuroonkologie ein großes therapeutisches Potenzial, um in Zukunft auch Hirntumor-Patienten und -Patientinnen mit bislang sehr schlechter Prognose ein längeres und besseres Überleben zu ermöglichen“, kommentiert abschließend Prof. Dr. Hans-Christoph Diener, Pressesprecher der DGN.
Quelle: Deutsche Gesellschaft für Neurologie
22.04.2021