Keine Verschnaufpause bei COPD
Trotz hoher Tabaksteuer und deutlichen Warnhinweisen auf den Zigarettenschachteln lassen sich viele Raucher das Ziehen am Glimmstengel nicht vermiesen. Die Zahl der Menschen in den Industrienationen, die an den Folgen ihres Tabakkonsums sterben oder frühzeitg invalide werden, steigt. Dabei stellt die chronisch obstruktive Lungenerkrankung (COPD) – meist verursacht durch Rauchen – eines der führenden Gesundheitsprobleme dar.
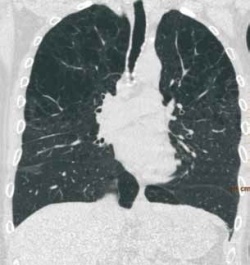
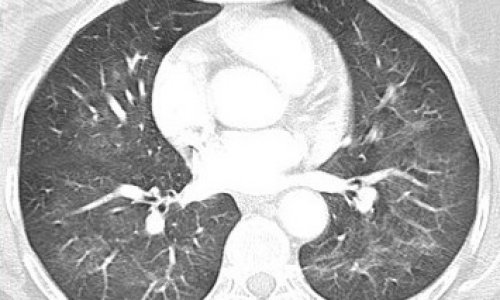
Sie ist zurzeit die viert häufigste Todesursache bei Erwachsenen mit steigender Tendenz. Doch die COPD kennt viele Gesichter und erfordert folglich unterschiedliche Behandlungsansätze. Multidetektor-CT-Scanner erlauben heute die Akquisition hoch auflösender 3-D-HRCT-Datensätze, die neue Möglichkeiten zur Differenzierung, Phänotypisierung und Quantifizierung der COPD bieten.
Dr. Cornelia Schaefer-Prokop, Fachärztin am Radiologischen Institut des Meander Medical Center in den Niederlanden, kennt das Problem rund um die Untergliederung der COPD: „Es handelt sich dabei um eine Kombination aus Emphysem und chronischer Bronchitis. Die COPD wird mithilfe von klinischen Lungenfunktionstests diagnostiziert und anschließend nach den sogenannten GOLD (global initiative for obstructive lung disease)-Kriterien 1 bis 4 eingestuft, die sich auf den Schweregrad der spirometrisch gemessenen Obstruktion beziehen. Diese Tests bilden jedoch lediglich die Funktion der gesamten Atemwege ab und verraten nicht, wie ausgeprägt die beiden Komponenten Emphysem und Bronchopathie vorhanden sind und welche von beiden dominiert. Entscheidend für eine zielgerichtetere Behandlung sind nach neuesten wissenschaftlichen Erkenntnissen jedoch genau diese Informationen.“
Das hängt vor allem mit den pathologischen Eigenschaften beider Krankheitsbilder zusammen. Das Emphysem bewirkt eine irreversible Erweiterung der Lufträume, die eine ebenfalls irreversible Destruktion der Alveolarwände zur Folge hat – am ausgeprägtesten in den Oberlappen. Die bereits entstandenen Schäden sind therapeutisch wenig bis gar nicht zu beheben. Anders bei der Bronchitis. Dabei kommt es durch den chronisch inflammatorischen Prozess zu einem Umbau der Atemwege. Die Bronchialwände werden dicker, während das Lumen sich verkleinert. Diese obstruktive Atemwegskomponente der Lungenerkrankung verursacht durch einen chronischen Entzündungsprozess, ist pharmakologisch besser behandelbar – so zumindest die Hoffnung der Mediziner. Hinter dem Begriff Phänotypisierung der COPD stehen die Bemühungen verschiedener Forschungsgruppen, diese beiden Komponenten zu differenzieren und zu quantifizieren und zwar in einem möglichst frühen Stadium. Dabei spielen nicht nur morphologisch-funktionelle Faktoren, sondern auch genetische Faktoren eine Rolle.
Die Computertomographie bietet eine hervorragende Möglichkeit, morphologisch – und indirekt auch funktionell – zwischen den beiden Komponenten des Emphysems und der Bronchopathie zu differenzieren und außerdem die regionale Verteilung der Pathologie abzubilden. „Neben der rein qualitativen Beschreibungen des Befunds werden zurzeit große Bemühungen unternommen, Verfahren zur quantitativen Beurteilung der pathophysiologischen Komponenten zu entwickeln“, erklärt Prof. Schäfer-Prokop, die selbst mit einer Forschungsgruppe von Nicht-Radiologen von der Universität Nijmegen an Quantifizierungskriterien arbeitet.
Einen besonders wichtigen Messparameter bilden dabei die Dichtewerte, fährt die Radiologin fort: „Beim Emphysem ist der am häufigsten verwendete Schwellenwert – 950 HU. Alles, was darunter liegt, wird als Emphysem angesehen. Um mehr über die bronchitische Komponente zu erfahren, wird ein CT in Inspiration und ein CT in Expiration aufgenommen. Dann werden die Dichtewerte miteinander verglichen. In Expiration werden bestimmte Gebiete sichtbar, die zeigen, dass der Sauerstoff in die Lunge rein, aber nicht mehr richtig rausgeht. Diesen sogenannten Air-Trapping-Faktor kann man mit der Bronchitis oder Bronchiolitis, der Obstruktion der kleinen Atemwege, korrelieren.“
Um diese Art von Differenzialdiagnostik durchführen zu können, braucht es spezielle Softwareprogramme, die zum Teil kommerziell verfügbar, zum Teil als Prototypen noch in der Entwicklung sind. „Das Problem ist, dass die Software von den industriellen Herstellern oder Wissenschaftsgruppen sehr unterschiedlich ist. Das heißt, hier ist kaum eine Vergleichbarkeit gegeben“, so Schäfer-Prokop.
Um die Quantifizierung jedoch in der Breite klinisch einzuführen, müssen erst einmal einheitliche Standards gefunden werden. Da es sich um eine sehr neue Methode handelt, befindet sie sich im Moment noch unter wissenschaftlicher Evaluation und führt dabei zum Teil auch zu kontroversen Ergebnissen. Viele Rahmenbedingungen für die Untersuchungen fehlen noch: Was genau wird überhaupt gemessen? Wie sind die morphologischen Zahlenwerte mit den gewonnenen Parametern aus den klinischen Lungenfunktionstests zu korrelieren? Was gibt es für Einflussfaktoren auf die Messwerte? „Es gibt viele verschiedene patienten- und technisch relevante Details, die zu berücksichtigen sind“, bestätigt die Radiologin. „Der Scannertyp, das Alter des Patienten, wie tief dieser inspiriert, welchen Schwellenwert zur Dichtemessung man verwendet, wie die Daten rekonstruiert werden usw.“
Hinzu kommt, dass auch von klinischer Seite noch hoher Forschungsbedarf besteht. Es ist zwar sehr wahrscheinlich, dass die Phänotypisierung in individuellere, frühzeitigere und damit bessere Therapien münden wird, aber klinische Studien, die diesen Standpunkt wissenschaftlich belegen, sind erst noch zu erarbeiten.
Im Profil
Dr. Cornelia M. Schaefer-Prokop, apl. Professorin der Radiologie an der MHH Hannover, ist seit 2009 am Meander Medical Center, Amersfoort, tätig. Ein Forschungsstipendium führte sie 1988 an das Mass. General Hospital, Harvard Medical School, Boston. Sie war als Radiologin an der MHH in Hannover und am AKH Wien beschäftigt, bevor sie in die Niederlande ging. Von 2005 bis 2009 arbeitete sie am AMC Amsterdam. Ihre besonderen Forschungsschwerpunkte liegen in der Digitalen Radiographie, Computer aided diagnosis (CAD) in CT und Radiographie und HRCT interstitieller Lungenerkrankungen. Schäfer-Prokop engagiert sich in zahlreichen nationalen und internationalen Radiologischen Gesellschaften. Sie ist u.a. Vorsitzende der niederländischen Thoraxsektion und Vorstandsmitglied der European Society for Thoracic Imaging (ESTI), für die sie 2014 die Kongresspräsidentschaft übernimmt.
05.01.2012