News • Genetische Abweichungen
Gleiche Mutation, unterschiedliche Krebsarten
Warum verursachen Veränderungen bestimmter Gene nur in bestimmten Organen Krebs? Wissenschaftler vom Deutschen Konsortium für translationale Krebsforschung (DKTK), der Technischen Universität München (TUM) und der Universitätsmedizin Göttingen haben nun nachgewiesen, dass Zellen, die aus verschiedenen Organen stammen, unterschiedlich empfänglich für aktivierende Mutationen in krebstreibenden Genen sind:
Die gleiche Mutation in Vorläuferzellen der Bauchspeicheldrüse führt zu grundlegend anderen Ergebnissen als im Gallengang. Das Team entdeckte erstmals, dass gewebespezifische genetische Interaktionen für die unterschiedliche Anfälligkeit von Gallengangs- und Bauchspeicheldrüsengewebe für krebstreibende Mutationen verantwortlich sind. Die Ergebnisse können dabei helfen, in Zukunft präzisere Therapien gegen diese Krebsarten zu entwickeln.
Die Forscher haben ihre Erkenntnisse jetzt im Fachjournal Cancer Discoveries veröffentlicht.
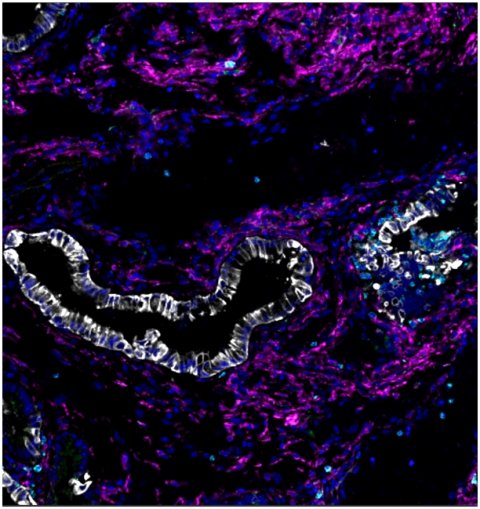
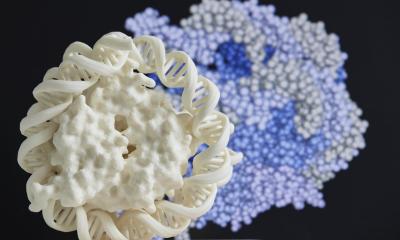
© T. Santos/DKTK & TUM
Die Behandlung von Bauchspeicheldrüsen- und Gallengangkrebs hat sich in den letzten Jahrzehnten nicht wesentlich verbessert, und bis heute gibt es keine wirksamen zielgerichteten Therapien. "Die Situation für Patienten mit Bauchspeicheldrüsen- und extrahepatischem Gallengangkrebs ist immer noch sehr bedrückend, nur etwa zehn Prozent der Betroffenen überleben fünf Jahre", sagt Dieter Saur, DKTK-Professor für Translationale Krebsforschung am DKTK-Partnerstandort München am Universitätsklinikum rechts der Isar der TUM. Im DKTK interagiert das Deutsche Krebsforschungszentrum (DKFZ) in Heidelberg als Kernzentrum langfristig mit onkologisch besonders ausgewiesenen universitären Partnerstandorten in Deutschland. "Um neue therapeutische Ansätze zu entdecken, die die Prognose dieser Patienten verbessern, müssen wir dringend die gewebespezifischen genetischen Netzwerke verstehen, die diese Tumoren steuern. Das kann uns dabei helfen, in Zukunft präzisere Therapien einzusetzen", so der Onkologe.
Das Forscherteam um Saur untersuchte die Entwicklung von Gallengangs- und Bauchspeicheldrüsenkrebs in Mäusen, bei denen die normalen "Onkogene" PIK3CA und KRAS durch mutierte Versionen ersetzt wurden. Diese Mutationen waren mit denen identisch, die die beiden Krebsarten beim Menschen antreiben. Die Expression der mutierten Onkogene in den gemeinsamen Vorläuferzellen des Gallengangs und in der Bauchspeicheldrüse führte zu sehr unterschiedlichen Ergebnissen. Mäuse mit dem mutierten PI3K-Gen entwickelten überwiegend Gallengangkrebs, Mäuse mit dem mutierten KRAS-Gen dagegen ausschließlich Bauchspeicheldrüsenkrebs. Dies war unerwartet, da beide Gene in beiden menschlichen Krebsarten mutiert sind. Weitere Analysen des Teams deckten die zugrundeliegenden genetischen Prozesse auf, die zu der unterschiedlichen Empfindlichkeit gegenüber den krebstreibenden Mutationen führen. "Unsere Ergebnisse sind ein wichtiger Schritt zur Lösung eines der größten Rätsel in der Onkologie: Warum verursachen Veränderungen bestimmter Gene nur in bestimmten Organen Krebs?", sagt Chiara Falcomatà, Erstautorin der aktuellen Publikation. "Unsere Studien an Mäusen haben gezeigt, wie Gene zusammenarbeiten, um Krebs in verschiedenen Organen zu verursachen. Wir haben die Hauptakteure identifiziert, die Reihenfolge, in der sie während der Tumorprogression auftreten, und die molekularen Prozesse, die normale Zellen in gefährliche Krebszellen verwandeln. Solche Prozesse sind potenzielle Ziele für neue Behandlungen."
Das Konzept, dass gewebespezifische genetische Interaktionen die Krebsentwicklung vorantreiben, zeigt, dass kein einzelnes Gen das Ansprechen einer Krebserkrankung auf eine bestimmte Therapie vorhersagen kann
Dieter Saur
In den Mäusen konnte das Team genetische Programme identifizieren, die die Entwicklung der beiden Krebsarten vorantreiben. So kooperieren beispielsweise verschiedene genetische Ereignisse und überaktivieren dadurch den PI3K-Signalweg, was die Zellen bösartig entarten lässt. Andere Mutationen setzten regulatorische Proteine außer Kraft, so dass sie ihre Fähigkeit verlieren, das Fortschreiten der Erkrankung zu bremsen. "Das Verständnis der genetischen Wechselwirkungen in verschiedenen Krebsarten kann in Zukunft zu präziseren therapeutischen Entscheidungen führen", sagt Günter Schneider, Professor für Translationale Krebsforschung an der Universitätsmedizin Göttingen. "Wir können spezifische genetische Veränderungen in Mäusen erzeugen und damit die Funktion von Krebsgenen untersuchen oder spezifische Krebs-Subtypen modellieren. Solche Mausmodelle sind von unschätzbarem Wert, um Krebsmedikamente zu testen, bevor sie in klinischen Studien eingesetzt werden."
"Was wir gezeigt haben, ist, dass die Funktion eines Onkogens abhängt vom Gewebetyp und davon, welche anderen Gene verändert sind", sagt Roland Rad, Professor an der TUM und DKTK-Forscher. "Damit es zur Krebsentstehung kommt, müssen diese Onkogene das intrinsische Signalnetzwerk eines bestimmten Gewebes kapern. Interessanterweise existieren solche Netzwerke nur in bestimmten Gewebetypen, die dadurch anfällig für die Krebsentstehung sind."
Diese Erkenntnisse des Teams um Saur, Schneider und Rad haben wichtige Implikationen für therapeutische Interventionen. "Das Konzept, dass gewebespezifische genetische Interaktionen die Krebsentwicklung vorantreiben, zeigt, dass kein einzelnes Gen das Ansprechen einer Krebserkrankung auf eine bestimmte Therapie vorhersagen kann", sagt Saur. "Um die Präzisionsmedizin auf die nächste Stufe zu heben, müssen wir in Zukunft besser verstehen, welche gewebespezifischen Determinanten ein therapeutisches Ansprechen oder eine Resistenz bestimmen."
Quelle: Deutsches Krebsforschungszentrum
19.07.2021