IT
Computergestützte Tumorverlaufskontrolle
Was hat sich verändert und was bedeutet die Veränderung? Das sind die zwei zentralen Fragen in der Tumorverlaufskontrolle. Und die Erfahrung hat gezeigt, dass der Mensch bei der präzisen Beantwortung dieser Fragen ziemlich rasch an seine Grenzen stößt.
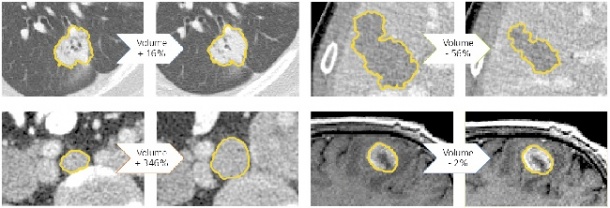
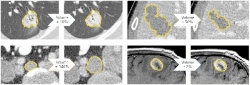
Kluge Softwareprogramme und Algorithmen können ihm jedoch dabei helfen, diese Schranken zu überwinden und die zeitliche Veränderung eines bösartigen Befunds besser zu charakterisieren.
„Im Wesentlichen sind es drei Bereiche, bei denen der Computer wertvolle Unterstützung leisten kann: die räumliche Korrelation von Läsionen, die Quantifizierung einer Veränderung und deren Klassifizierung“, weiß Prof. Dr. Horst Karl Hahn, Leiter des Fraunhofer-Instituts MEVIS in Bremen.
Räumliche Korrelation
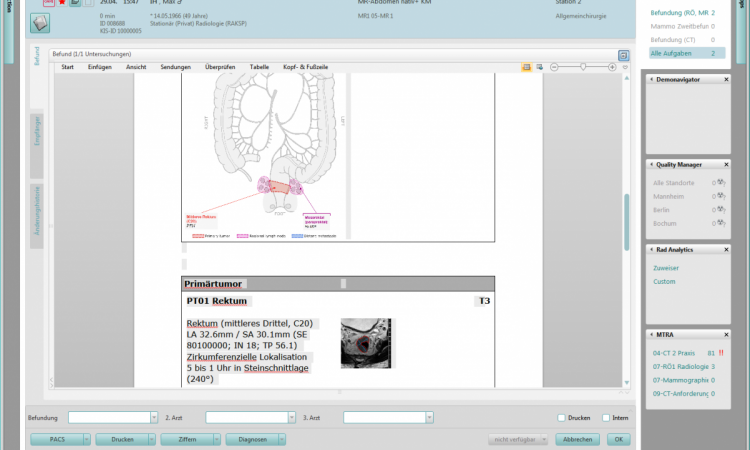
Bei der räumlichen Korrelation, die in der sogenannten Bildregistrierung ihre technische Entsprechung findet, erleichtert die Software das Auffinden der relevanten Schichtareale bei zeitlich getrennten Aufnahmen. Das ist deshalb hilfreich, weil sich in der Zeit zwischen aktueller Untersuchung und Voruntersuchung nicht nur der Tumor verändert: Menschen bewegen sich, Menschen nehmen ab oder zu und auch die Untersuchungen werden nicht identisch durchgeführt. Die Registrierung überträgt die Markierung in einem Datensatz automatisch auf die Voruntersuchung, sodass der Radiologe nicht durch zwei komplette Datensätze scrollen muss. Einige Softwareanbieter bieten eine solche Registrierung bereits an, allerdings „handelt es sich dabei zumeist um eine Grobregistrierung, die an ihre Grenzen stößt, sobald es sich um stark deformierbares Gewebe handelt, wie etwa bei der Mammographie im Vergleich zu einer MRT-Untersuchung der Brust“, so Horst Karl Hahn.
Quantifizierung
Beim zweiten Punkt, der Quantifizierung, liegen mittlerweile Untersuchungen vor, welche die Vorteile einer computergestützten Messung belegen: Bis zu zehnmal genauer lässt sich die Größe beziehungsweise die Größenänderung einer Läsion mittels Software im Vergleich zu herkömmlichen Messmethoden darstellen. Zur Bestimmung der Größe liegen heute bereits Softwarelösungen vor. Der Durchmesser allein ist bei der Beurteilung eines Therapieerfolgs jedoch nur bedingt hilfreich. Aussagekräftiger wäre die exakte Darstellung des Volumens eines Tumors, was mittlerweile technisch ebenfalls möglich ist, in der Praxis jedoch noch nicht flächendeckend zum Einsatz kommt. „Ein weiteres Ziel der Forschung ist die funktionelle und metabolische Quantifizierung, um die Aggressivität eines Tumors zu bestimmen“, ergänzt Hahn.
Klassifizierung
Auch bei der Klassifizierung gibt es bereits erste Ansätze für spezifische Applikationen. Die Herausforderung besteht hier im Aufbau der Datenbank, auf die ein System zurückgreifen kann, um eine bestimmte Pathologie zu vergleichen und Aussagen über deren Charakter zu treffen. Auf diesem Gebiet gibt es noch immensen Forschungsbedarf und nicht zuletzt steht hier eine ganz zentrale und menschliche Frage im Raum: „Darf ein Computer die Untersuchungsergebnisse interpretieren? Auf welche Weise die Ergebnisse einer solchen Klassifizierung in den Be- fundungsprozess einfließen sollten, wird derzeit kontrovers diskutiert. Das langfristige Ziel einer konsequenten Entscheidungsunterstützung basierend auf den verfügbaren klinischen Daten, etwa durch Berechnung einer Wahrscheinlichkeit für das Ansprechen einer Chemotherapie, wird jedoch kaum mehr infrage gestellt“, schließt Horst Karl Hahn.
PROFIL:
Nach dem Physikstudium begann Prof. Dr. Horst Karl Hahn als wissenschaftlicher Mitarbeiter beim Forschungszentrum MeVis Research, wo er initial die Forschungsgruppe Neuroimaging leitete. 2006 wurde er Forschungsdirektor und Vizepräsident des Instituts. 2007 berief ihn die Jacobs University Bremen zum Professor für medizinische Visualisierung. Seit Mai 2014 ist er Leiter des Fraunhofer-Instituts MEVIS.
30.05.2014