News • Kinderkrebsforschung
Atlas zeigt genetischen „Fingerabdruck“ von Hirntumoren bei Kindern
Ein internationales Forscherteam unter Leitung des Forschungsinstituts Kinderkrebs-Zentrum Hamburg und des KiTZ Hopp-Kindertumorzentrums Heidelberg hat einen Meilenstein in der Kinderkrebsforschung erreicht.

© Forschungsinstitut Kinderkrebs-Zentrum Hamburg
In einer in der Fachzeitschrift Nature Genetics veröffentlichten Studie präsentieren die Wissenschaftler den weltweit umfassendsten epigenetischen Atlas von Mausmodellen für kindliche Krebserkrankungen. Die Arbeit verspricht ein besseres Verständnis der Entstehung von Hirntumoren bei Kindern und könnte neue Ansatzpunkte für gezieltere Therapien liefern.
Für die Studie haben die Forscher Mausmodelle aus 20 internationalen Laboren zusammengetragen – insgesamt 106 verschiedene Modelle für 31 verschiedene Tumorarten bei Kindern. Zusätzlich hat das Team in Heidelberg 18 neue Modelle für kindliche Hirntumoren entwickeln können. „Diese globale Zusammenarbeit war entscheidend", erklärt Professor Ulrich Schüller, Direktor des Forschungsinstituts Kinderkrebs-Zentrum Hamburg. „Nur durch die Bündelung weltweiter Expertise konnten wir diesen umfassenden Atlas erstellen."

© Philip Benjamin I DKFZ
Kindliche Hirntumoren wie das pädiatrische hochgradige Gliom oder das Medulloblastom gehören zu den aggressivsten Krebserkrankungen im Kindesalter. Eine besondere Herausforderung ist ihre enorme Vielfalt: Jeder Tumor ist molekular anders aufgebaut. „Wir wissen, dass sogenannte Kopienzahlveränderungen – also das Fehlen oder die Verdopplung größerer Erbgutabschnitte – eine wichtige Rolle spielen", sagt Dr. Marc Zuckermann vom Hopp-Kindertumorzentrum Heidelberg KiTZ und vom Deutschen Krebsforschungszentrum (DKFZ), der die Studie gemeinsam mit Ulrich Schüller leitete. „Aber ihre genaue Funktion bei der Tumorentstehung war bisher ein Rätsel, weil uns die richtigen Werkzeuge zur Erforschung fehlten."
Die Analyse der DNA-Methylierung – eine Art molekularer Fingerabdruck – zeigte, dass die Mausmodelle ihren menschlichen Gegenstücken verblüffend ähnlich sind. Auch die Zusammensetzung der Immunzellen im Tumor stimmt zwischen Maus und Mensch weitgehend überein.
Außerdem fanden die Forschenden heraus, dass Kopienzahlveränderungen kein Zufall sind: In den Mausmodellen treten diese genetischen Veränderungen hochgradig wiederkehrend auf – und zwar spezifisch für jeden Tumortyp. Das deutet auf eine essenzielle Rolle bei der Tumorentstehung hin. Die in Mäusen beobachteten Veränderungen der Kopienzahl traten in ähnlicher Form auch bei menschlichen Patienten mit derselben Tumorart auf. Die Mausmodelle sind also zur Erforschung dieser Mechanismen bei Menschen geeignet. Das Team beobachtete zudem, dass sich die Tumoren gezielt weiterentwickeln: Selbst, wenn Tumorzellen mehrfach in neue Mäuse übertragen werden, entwickeln sie immer wieder dieselben genetischen Veränderungen – ein Zeichen für eine gerichtete, nicht zufällige genetische Tumorentwicklung.

© Forschungsinstitut Kinderkrebs-Zentrum Hamburg
„Unsere Ergebnisse legen den Grundstein für ein viel detaillierteres Verständnis dafür, wie kindliche Hirntumoren entstehen", betont Dr. Melanie Schoof, eine der Erstautorinnen der Studie, vom Forschungsinstitut Kinderkrebs-Zentrum Hamburg. „Die Mausmodelle ermöglichen es uns erstmals, die Rolle dieser genetischen Veränderungen während der Tumorentstehung zu untersuchen – und zwar in einem Stadium, das bei menschlichen Patienten nicht zugänglich ist."
Dies könnte mittelfristig zu einer verbesserten Behandlung von Hirntumoren führen, da zum einen passende Mausmodelle für präklinische Studien eingesetzt werden und zum anderen ganz neue Therapien entwickelt werden können, für die auch Kopienzahlveränderungen berücksichtigt werden. „Je genauer wir Tumoren molekular verstehen und modellieren können, desto gezielter können wir sie behandeln", erklärt Schüller. „Unser Ziel ist es, für jeden kleinen Patienten die individuell beste Therapie zu finden."
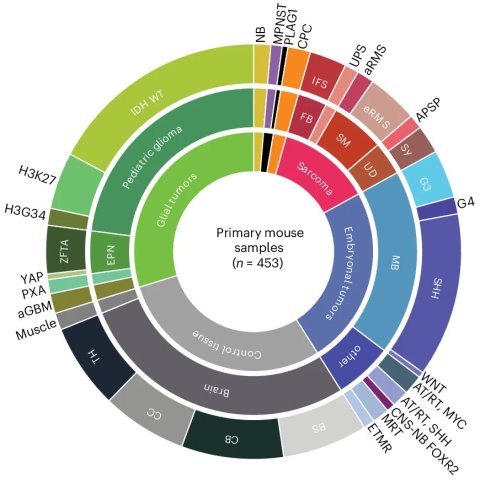
Bildquelle: Schoof M, Zheng T, Sill M et al., Nature Genetics 2025 (CC BY 4.0)
Die Studie wurde unter anderem vom Europäischen Forschungsrat (ERC) und der Deutschen Forschungsgemeinschaft (DFG) gefördert. Sie ist ein Beispiel für die enge Verzahnung von Grundlagenforschung und klinischer Versorgung am Universitätsklinikum Hamburg-Eppendorf (UKE). „Was wir im Labor entdecken, soll so schnell wie möglich den Kindern auf der Station helfen", so Schüller.
Der nun veröffentlichte Atlas steht der internationalen Forschungsgemeinschaft zur Verfügung und wird bereits weltweit für neue Studien genutzt. „Wir haben die Tür zu einem ganz neuen Forschungsfeld aufgestoßen", sagt Zuckermann. „Jetzt gilt es, diese Erkenntnisse in konkrete Therapieansätze zu übersetzen."
Quelle: Forschungsinstitut Kinderkrebs-Zentrum Hamburg
16.12.2025