© Universitätsklinikum Bonn
News • Neue Therapieform
„Spiegel“-RNA gegen Glioblastome
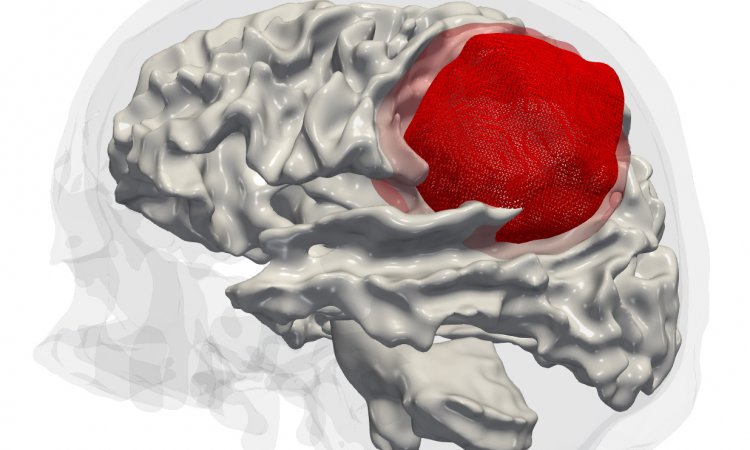
Glioblastome sind besonders aggressive Hirntumore, die schnell auch in das gesunde Hirngewebe hineinwuchern. Da die Tumore chirurgisch meist nicht vollständig entfernt werden können, ist die Prognose von Glioblastom-Patienten sehr schlecht.
Die Standardtherapie – bestehend aus einer Kombination von Operation, Bestrahlung und Chemotherapie – verspricht keine Heilung. Mit Hochdruck wird daher nach erfolgreichen Behandlungsmöglichkeiten gesucht. Wissenschaftler der Universitätsmedizin Mannheim (UMM), des DKFZ-Hector Krebsinstitutes an der UMM und des Universitätsklinikums Bonn (UKB) erforschen eine neue Therapie mit einer neuartigen Medikamentenklasse von gespiegelten RNA-Polymeren, sogenannten Spiegelmeren, die die Regeneration des Glioblastoms blockieren soll.
Unter Mannheimer Federführung wurde dazu 2019 an sechs deutschen Universitätsklinika eine Studie gestartet (GLORIA), deren Ergebnisse aktuell im Journal Nature Communications publiziert sind. Erstmals soll bei Glioblastom-Patienten mehrstufig untersucht werden, wie der Wirkstoff Olaptesed Pegol (NOX-A12,TME Pharma) gezielt in Verbindung mit einer Strahlentherapie wirkt. „Das Besondere an unserem Therapieansatz ist, dass wir unseren Blick nicht mehr nur auf die Strahleneffekte in Tumorzellen fokussieren, sondern vor allem auf deren Umgebung, das sogenannte Tumormikromilieu. Das Spiegelmer NOX-A12 unterbindet die Ausbildung von neuen Blutgefäßen über einen Mechanismus, der speziell nach der Strahlentherapie von verbleibenden Tumorzellen angekurbelt wird, um sich zu regenerieren“, erklärt Professor Dr. Frank Giordano, Direktor der Klinik für Strahlentherapie und Radioonkologie an der UMM, der auch am DKFZ-Hector Krebsinstitut forscht.
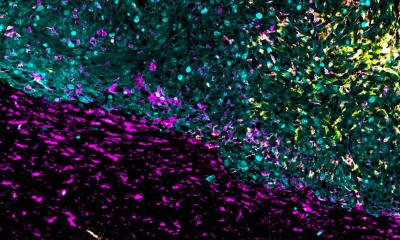
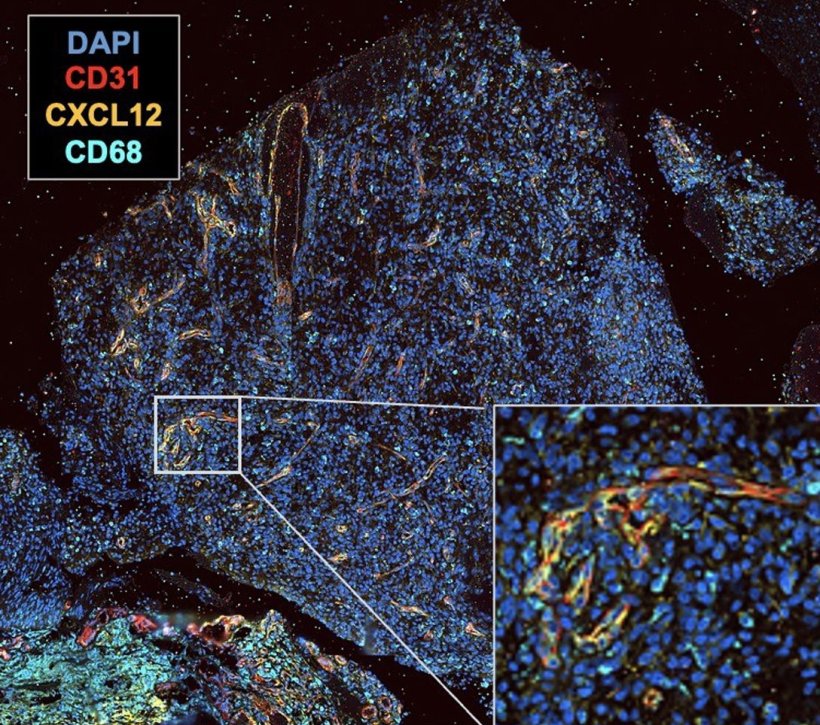
Wenn die Tumorzellen und interessanterweise auch die Gefäßzellen selbst viel CXCL12 herstellen, scheint dies mit einem besseren Ansprechen auf die NOX-A12 Therapie zu korrelieren
Michael Hölzel
Tumorzellen sind auf die Versorgung mit Nährstoffen und Sauerstoff im Blut angewiesen. Sie senden daher Botenstoffe aus, die die Bildung von neuen Blutgefäßen fördern und sie dazu anregen, in Richtung des Tumors zu wachsen und diesen zu versorgen. Auch die tödlichen Hirntumore versuchen, sich nach der Therapie auf diese Weise zu regenerieren. CXCL12 ist ein solch körpereigener Botenstoff, der die Gefäßbildung anregt. Das Spiegelmer NOX-A12 inhibiert CXCL12 und torpediert damit die Regeneration des Tumors. „Interessant ist, dass das Prinzip offenbar nur in Kombination mit der Strahlentherapie funktioniert, da die Glioblastome diesen Reparaturmechanismus über CXCL12 besonders nach der Bestrahlung anwenden“, betont Professor Giordano.
In einer ersten Studie der Phase I/II, wurde die neue Therapie erstmals an einer kleinen Gruppe von Patienten mit einem neu diagnostizierten Glioblastom, die gegen die Standardtherapie resistent sind, untersucht. Ziel dabei ist es vor allem, Informationen über die Sicherheit und erste Anhaltspunkte zur Wirksamkeit von NOX-A12 in Kombination mit Strahlentherapie zu erhalten.
Darüber hinaus lieferte die Studie auch neue Erkenntnisse, die für die weitere Entwicklung der NOX-A12 Therapie wichtig sind. Unter Leitung von Forschungsgruppen am Universitätsklinikum Bonn wurden dazu Gewebeproben der Tumore mit modernsten Verfahren untersucht. „Wenn die Tumorzellen und interessanterweise auch die Gefäßzellen selbst viel CXCL12 herstellen, scheint dies mit einem besseren Ansprechen auf die NOX-A12 Therapie zu korrelieren“, erklärt Professor Dr. Michael Hölzel, Direktor des Instituts für Experimentelle Onkologie am UKB, der auch an der Uni Bonn forscht. „Jedoch bedarf es weiterer Studien und einer größeren Anzahl an Proben, um diese Beobachtung wirklich zu belegen“, schränkt Professor Hölzel ein.
Die ersten Daten sind jedoch bereits so vielversprechend, dass die US-amerikanische Gesundheitsbehörde (Food and Drug Administration, FDA) nicht nur den Antrag für NOX-A12 als neues Prüfpräparat (Investigational New Drug, IND) anerkannt hat, sondern auch den Antrag auf ein beschleunigtes Zulassungsverfahren für Arzneimittel (Fast-Track Designation) befürwortet hat, und somit einen sonst mehrjährigen Prozess abkürzt.
Quelle: Universitätsmedizin Mannheim
31.05.2024