Bildquelle: Adobe Stock/Axel Kock
News • Resistenz-Gen mcr-1 auf der Spur
Reserve-Antibiotikum: Forscher kämpfen gegen Colistin-Resistenz
Colistin ist ein Reserveantibiotikum der letzten Wahl für die Behandlung von Infektionen, die durch extrem multiresistente (XDR) gramnegative Bakterien verursacht werden. Das jüngste Auftreten und die weltweite Ausbreitung des mobilen Colistin-Resistenzgens mcr-1 in vielen Bakterienarten und in verschiedenen Umgebungen – unter anderem in Lebensmitteln, Tieren und Menschen – stellt eine erhebliche Bedrohung der öffentlichen Gesundheit dar.
Die Funktionsweise und der Erfolg von mcr-1 als Resistenzfaktor sind jedoch nicht vollständig geklärt. Eine Studie unter der Leitung von Forschenden des Deutschen Zentrums für Infektionsforschung (DZIF), die kürzlich in der Fachzeitschrift Microbiology Spectrum veröffentlicht wurde, liefert entscheidende Antworten auf die Frage, wie der Erwerb von mcr-1 den Bakterien zugutekommt und untersucht einen Ansatz zur Beseitigung von mcr-1 und seiner Übertragungsvektoren.
Colistin ist ein kationisches zyklisches Peptid, das die bakteriellen Zellmembranen von gramnegativen Bakterien zerstört. Es ist eines der wenigen verbleibenden Reserveantibiotika für den Einsatz gegen Infektionen mit multiresistenten Bakterien. Daher hat der jüngste weltweite Nachweis übertragbarer mobiler Colistin-Resistenzgenfamilien in einem breiten Spektrum multiresistenter gramnegativer Bakterien, die aus allen möglichen Umgebungen – darunter Krankenhäusern, Tiermedizin, Lebensmittel und Aquakultur – isoliert wurden, die Alarmglocken schrillen lassen. Dennoch blieb der Erfolg von mcr-1 als übertragbarer Resistenzfaktor rätselhaft, da seine Expression einen selektiven Nachteil für die Wachstumseigenschaften von Bakterien darstellt, während er nur ein moderates Maß an Resistenz gegenüber Colistin verleiht.
Dieser Artikel könnte Sie auch interessieren

Artikel • AMR-Themenkanal
Antibiotikaresistenz: eine globale Bedrohung
Antibiotikaresistenz (AMR) stellt eine zunehmende Bedrohung für die öffentliche Gesundheit auf der ganzen Welt dar. Bakterien, die gegen verfügbare Antibiotika resistent werden, machen alltägliche medizinische Verfahren aufgrund des hohen Infektionsrisikos unmöglich. Lesen Sie weiter und erfahren Sie mehr über die AMR-Forschung, die Entwicklung neuer Antibiotika und Antibiotika-Alternativen.
Ein internationales Team unter Leitung von Wissenschaftlern des DZIF hat nun herausgefunden, warum die Aufnahme von mcr-1 – trotz seiner Nachteile – für Bakterien von Vorteil ist. Ihre Studie deutet darauf hin, dass der Erwerb von mcr-1 einen spezifischen physiologischen Zustand in Bakterien hervorruft, der die Resistenz gegen häufig auftretende Umweltstressbedingungen wie Veränderungen des Säuregehalts und antimikrobielle Peptide fördert. „Wir haben entdeckt, dass in Bakterien, die das mcr-1-Gen tragen, regulatorische Komponenten der bakteriellen Stressantwort – eines Systems, das Schwankungen in der Nährstoffverfügbarkeit und Umweltveränderungen wahrnimmt – aktiviert werden. Dadurch wird die Produktion des MCR-1-Proteins stark erhöht und das Überleben der Bakterien in Umgebungen mit niedrigem pH-Wert gefördert“, sagt die Erstautorin der Studie, Dr. Renate Frantz vom Lehrstuhl für Medizinische Mikrobiologie der Justus-Liebig-Universität Gießen.
Die Ergebnisse deuten darauf hin, dass die Integration der MCR-1-abhängigen Resistenzaktivität in die Stressantwort die Resistenz von Stämmen in Umgebungen unterstützt, die für Bakterienzellen belastend sind, beispielsweise während der Passage durch den Magen-Darm-Trakt oder wenn sie Gallensäure ausgesetzt sind. „Unsere Analysen haben außerdem gezeigt, dass die Produktion des Proteins MCR-1 in Bakterien, die unter mäßig sauren Bedingungen wachsen, zu einer verstärkten Modifikation von Lipid A, der Ankerstruktur von Lipopolysacchariden, führt – einer entscheidenden Komponente der bakteriellen Membran, die für die Colistin-Resistenz erforderlich ist“, sagt Dr. Nicolas Gisch vom Forschungszentrum Borstel, dem Leibniz Lungenzentrum, einer der Erstautoren der Publikation.
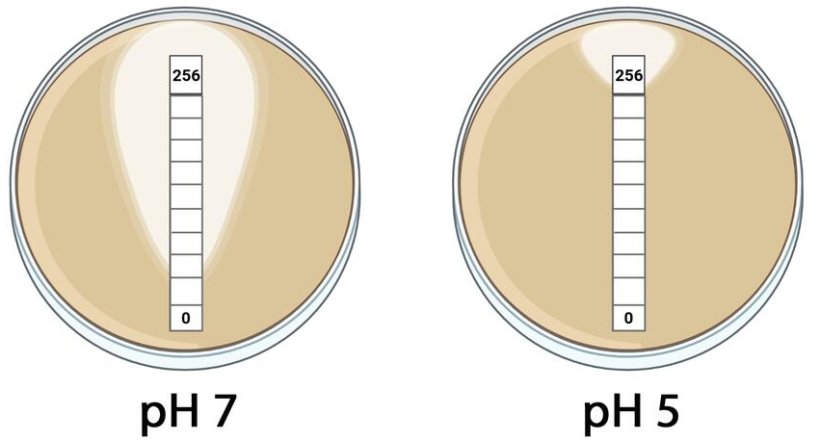
Bildquelle: DZIF; © Frantz R. et al., 2023/Renate Frantz
Ausgehend von der Erkenntnis, dass die MCR-1-Enzymaktivität unter sauren Bedingungen stark erhöht ist, entwickelte das Forscherteam einen einfachen und leicht reproduzierbaren Assay, um die MCR-1-abhängige Colistin-Resistenz in Bakterienisolaten zuverlässig zu bestimmen.
Die Produktion des MCR-1-Proteins induziert auch die Expression von DegP, einer Protease im Periplasma des Bakteriums (dem Raum zwischen innerer und äußerer Membran bei gramnegativen Bakterien), die MCR-1 an einer spezifischen Stelle innerhalb einer hochkonservierten Region des Proteins spaltet. „Die Veränderung der Spaltstelle von MCR-1 hat tiefgreifende Auswirkungen sowohl auf die Resistenzaktivität als auch auf die Auslösung der bakteriellen Stressreaktion“, ergänzt Co-Autor Dr. Konrad Gwozdzinski, ehemaliger DZIF-Forscher und jetzt Senior Scientist bei Mondelēz International.
Diese Einblicke in die biomolekularen Grundlagen der MCR-1-abhängigen Resistenz ermöglichten es dem Team, eine allgemeine Strategie zu entwickeln, die die gezielte Aktivierung einer Protease einsetzt, um mcr-1-tragende Plasmide aus ihren bakteriellen Wirten zu entfernen. „Die Entwicklung eines einfachen diagnostischen Tests hat wichtige Auswirkungen auf die künftige Verwendung des Antibiotikums Colistin im klinischen Bereich“, kommentiert Prof. Trinad Chakraborty, ehemaliger Direktor des Instituts für Medizinische Mikrobiologie der Justus-Liebig-Universität, der die Studie leitete. „Unsere Daten ermöglichten es uns auch, einen neuartigen Ansatz zur Beseitigung der übertragbaren Colistin-Resistenz bei gramnegativen Bakterien zu entwickeln, um deren Verbreitung und Ausbreitung in der Umwelt zu verhindern“.
Diese Studie wurde am Institut für Medizinische Mikrobiologie der Justus-Liebig-Universität Gießen in Zusammenarbeit mit der Forschungsgruppe Bioanalytische Chemie des Forschungszentrums Borstel und dem Zentrum für Medizinische Biotechnologie der Universität Duisburg-Essen durchgeführt.
Quelle: Deutsches Zentrum für Infektionsforschung
11.05.2023