News • Ionenkanäle im Hirn
NDMA-Rezeptoren bergen Potenzial für Alzheimer-Behandlung
Bei der Suche nach neuen Alzheimer-Medikamenten ist ein vielversprechender Ansatz die Hemmung bestimmter Ionenkanäle im Hirn, da die durch Überaktivierung am Fortschritt der Krankheit beteiligt sind.
Das Problem dabei: Zwar sind diese sogenannten NMDA-Rezeptoren als möglicher Ansatzpunkt seit Jahrzehnten bekannt, doch fehlte es bisher an dem Wissen, wie die Inhibitoren dort ihre Wirkung entfalten – und erst mit entsprechenden Erkenntnissen ließen sich auf dieser Basis Alzheimer-Medikamente entwickeln. Die Lücke schließt nun eine Forschergruppe aus der Pharmazeutischen Chemie und der Medizin der Universität Münster (WWU): Dem Team um Prof. Bernhard Wünsch und Prof. Guiscard Seebohm ist es gelungen, einen gemeinsamen Wirkmechanismus von Ifenprodil und weiteren Inhibitoren zu entschlüsseln.
Das Fachjournal „Communications Biology“ veröffentlicht die wichtige Entdeckung in der aktuellen Ausgabe.
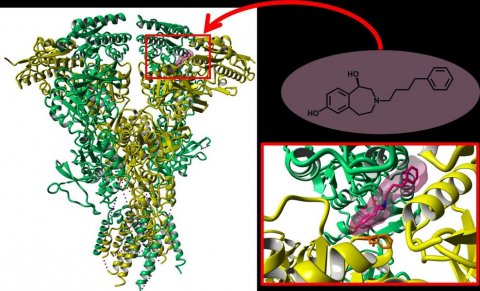
Abbildung: WWU/Julian Schreiber
NMDA-Rezeptoren sind Ionenkanäle, die im Gehirn an zentralen Prozessen des Lernens und Denkens beteiligt sind. Sie können aus verschiedenen Untereinheiten gebildet werden, nämlich GluN1, GluN2A-D oder GluN3A-B, und werden über den wichtigsten erregenden Neurotransmitter Glutamat aktiviert. Ein funktioneller Kanal besteht aus zwei GluN1-Untereinheiten und zwei weiteren GluN2- oder GluN3-Untereinheiten. Jede dieser Untereinheiten setzt sich zusammen aus circa 900 bis 1.400 einzelnen Aminosäuren; ein vollständiger NMDA-Rezeptor umfasst somit über 4.000. Besonders die GluN2B-Untereinheit ist mit der Entstehung verschiedener neurodegenerativer Erkrankungen verbunden, dazu zählen Morbus Parkinson und Morbus Alzheimer. Durch eine erhöhte Ausschüttung von Glutamat kommt es zur verstärkten Aktivierung des Rezeptors, die wiederum eine erhöhte Calciumkonzentration und Absterben in den neuronalen Zellen (Exzitotoxizität) hervorruft. Dies reduziert die Anzahl an Neuronen - die Leistungsfähigkeit des Gehirns sinkt.
Die erhöhte Freisetzung von Glutamat im Verlauf der Erkrankung rückt den NMDA-Rezeptor in das Zentrum der medikamentösen Therapie. So ist mit dem Medikament Memantin bereits ein NMDA-Blocker zur Therapie der moderaten bis schweren Alzheimer-Demenz zugelassen. Allerdings sind die Nebenwirkungen vielseitig, da Memantin ohne Unterschied alle NMDA-Rezeptoren blockiert und nicht nur die mit GluN2B-Untereinheit. Eine selektive Inhibition könnte die Nebenwirkungen reduzieren. Der erste Prototyp für einen solchen Inhibitor ist Ifenprodil (enthalten in Vadilex), der bereits seit 1971 bekannt ist – als Mittel gegen Bluthochdruck. Erst deutlich später wurde nachgewiesen, dass der Arzneistoff nur NMDA-Rezeptoren mit GluN2B-Untereinheit hemmt.
Obwohl Ifenprodil an den übrigen NMDA-Rezeptoren nicht wirkt, kann es aufgrund seiner Aktivität an anderen Rezeptor-Typen (5HT2-, σ1-, σ2- und α1-Rezeptoren) nicht zum Schutz neuronaler Zellen eingesetzt werden. Daher entwickelte die Forschergruppe um Prof. Wünsch vom Institut für Pharmazeutische und Medizinische Chemie der WWU neuartige Moleküle, die sich in ihrer Struktur von Ifenprodil ableiten, jedoch nur eine Aktivität an den „richtigen“ NMDA-Rezeptoren zeigen: die 3-Benzazepine. „Sie stellen einen wichtigen Schritt in Richtung der Medikamentenentwicklung auf Basis von hoch selektiven und wirksamen GluN2B-selektiven Inhibitoren dar“, betont Wünsch die Relevanz der Moleküle.
Die Verbindungen inhibieren den NMDA-Rezeptor, indem sie ihn in seiner geschlossenen Form gefangen halten
Guiscard Seebohm
Obwohl Ifenprodil und die 3-Benzazepine in mehreren Untersuchungen ihre Aktivität an NMDA-Rezeptoren mit GluN2B-Untereinheit unter Beweis gestellt haben, blieb ihr Wirkmechanismus auf molekularer Ebene bislang unbekannt. Erst eine Kooperation des Wünsch-Teams mit der Arbeitsgruppe von Prof. Guiscard Seebohm, Leiter der Abteilung zelluläre Elektrophysiologie und Molekularbiologie des Instituts für Genetik von Herzerkrankungen, brachte Licht in das Dunkel. Um zu klären, wie der Prozess auf molekularer Ebene abläuft, kombinierten die Wissenschaftler Techniken der Medizinischen Chemie, der Elektrophysiologie, der computerbasierten Simulation und der Molekularbiologie.
Nach vierjähriger Arbeit und zahlreichen Experimenten konnte ein gemeinsamer Mechanismus für Ifenprodil und die 3-Benzazepine beschrieben werden. „Die Verbindungen inhibieren den NMDA-Rezeptor, indem sie ihn in seiner geschlossenen Form gefangen halten“, beschreibt Prof. Seebohm den zentralen Befund. Die Bindung der Substanzen an den Rezeptor habe zur Folge, dass ein Teil des Rezeptors in seiner Bewegungsfreiheit eingeschränkt sei. „Dieser Mechanismus wird durch eine Interaktion mit einer einzelnen Aminosäure des Rezeptors erreicht“, sagt Dr. Julian Schreiber, der Erstautor der jetzt veröffentlichten Studie. Durch die die eingeschränkte Bewegung könne der Rezeptor nicht mehr in seine aktive Form wechseln, solange der Inhibitor mit dem Rezeptor interagiert.
Durch die Entdeckung dieses Mechanismus, der für mehrere potenzielle Medikamentenkandidaten identisch ist, kommt die Forschung auf dem Weg zu einer neuen medikamentösen Behandlung der Demenz einen großen Schritt weiter. Die dem Erfolg zugrundeliegende interdisziplinäre Zusammenarbeit im Grenzbereich der Naturwissenschaften und der Medizin wird an der WWU Münster in Form der Graduiertenschule „Chembion“ auch künftig bestehen bleiben.
Quelle: Westfälische Wilhelms-Universität Münster (WWU)
20.12.2019