Evolution
Enzyme: Geringer Aufwand, große Wirkung
Pflanzen, Pilze und Bakterien bieten ein fast unerschöpfliches Reservoir an biologisch aktiven Substanzen. Viele dieser Stoffe spielen eine wichtige gesundheitliche oder wirtschaftliche Rolle, weil sie als Antibiotika, Herbizide oder Insektizide genutzt werden können. Wie es der Natur gelingt, die Substanzen herzustellen, hat nun ein Forscherteam der Universität Regensburg um Prof. Dr. Reinhard Sterner, Prof. Dr. Rainer Merkl und Maximilian Plach vom Institut für Biophysik und physikalische Biochemie beleuchtet.
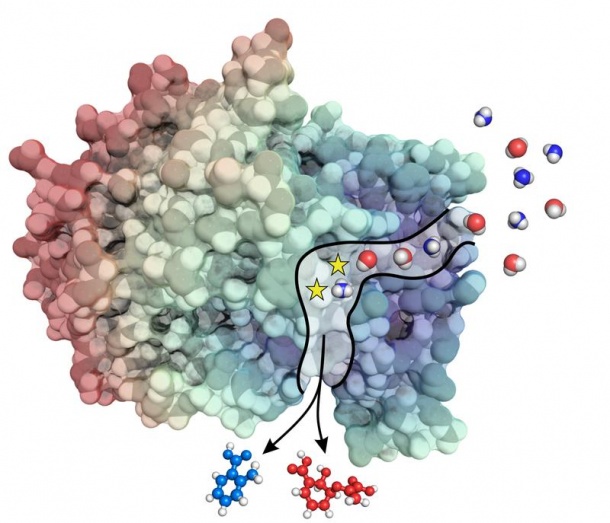
Für die meisten Stoffwechselvorgänge in der Natur sind Biokatalysatoren bzw. Enzyme notwendig. Für die Synthese von komplexen Komponenten – beispielsweise einem Antibiotikum oder einem Energiebaustein – müssen sogar mehrere Enzymreaktionen im Rahmen eines Stoffwechselweges verknüpft werden. Stoffwechselwege lassen sich dabei in zwei Klassen einteilen. Solche, die für einen lebenden Organismus unverzichtbar sind, bilden zusammen den primären Stoffwechsel. Dazu zählen der Abbau von Nahrung, die Bereitstellung von Energie oder der Aufbau von Zellbestandteilen. Die Reaktionen, die für den Organismus nicht lebensnotwendig sind, bilden den sekundären Stoffwechsel. Dessen Endprodukte sind unter anderem Substanzen wie Antibiotika, die in die Umwelt abgegeben werden, um beispielsweise Nahrungskonkurrenten auszuschalten.
Gängige Forschungsmeinung ist, dass die Enzyme des sekundären Stoffwechsels im Laufe der Evolution aus jenen des primären Stoffwechsels entstanden sind. Genduplikationen dieser Art kommen in der Natur häufig vor, wobei nicht selten auch Kopien primärer Enzyme entstehen. So ging man bislang davon aus, dass sich durch – auf natürlichem Wege – anhäufende Mutationen in einer Kopie eine neue Enzymfunktion ausbilden kann, die dann im günstigsten Fall im sekundären Stoffwechsel Verwendung findet.
Den Regensburger Forschern ist es nun gelungen, einen anderen Weg zur Synthese von Enzymen des sekundären Stoffwechsels aufzuzeigen. Dazu verglichen die Wissenschaftler ein Enzym aus dem Primärstoffwechsel (Anthranilat-Synthase) mit einem Enzym aus dem Sekundärstoffwechsel (Isochorismat-Synthase) mit bioinformatischen Verfahren am Computer. Beide Enzyme ähneln sich stark in ihrer Struktur. Allerdings nutzt die Anthranilat-Synthase Ammoniak für die Bildung der Carbonsäure Anthranilat. Die Isochorismat-Synthase greift hingegen auf Wasser zur Bildung von Isochorismat zurück, das wiederum für die Synthese von Enterobactin, einer eisenbindenden Verbindung, benötigt wird.
Auf der Grundlage ihrer bioinformatischen Analysen erzeugten die Forscher um Sterner, Merkl und Plach gezielt eine Anthranilat-Synthase, die Wasser als Reaktionsbestandteil nutzen kann. Zur Überraschung der Wissenschaftler war es dazu lediglich nötig, zwei der über 500 Aminosäuren des Enzyms zu verändern. Darüber hinaus erstaunlich: Die künstlich hergestellte Anthranilat-Synthase war immer noch in der Lage, auch Ammoniak als Reaktionsbestandteil zu nutzen.
Die Regensburger Forscher folgern daraus, dass für die Entstehung des Enzyms Isochorismat-Synthase im Laufe der Evolution zunächst einmal keine Verdopplung der Erbinformation der Anthranilat-Synthase notwendig war. Vielmehr könnte eine Anthranilat-Synthase mit zwei Funktionen – so wie das vom Regensburger Team künstlich erzeugte Enzym – für einen Organismus der wesentlich sparsamere und effizientere Zugang zu auf Isochorismat basierenden Molekülen des sekundären Stoffwechsels gewesen sein.
Diese Beobachtungen haben Konsequenzen für unser Verständnis, wie die Natur mit dem verfügbaren Bausatz an Proteinen und Enzymen immer neue biologisch aktive Moleküle entwickeln kann und entwickelt hat.
Quelle: Universität Regensburg
13.11.2015