News • Lymphozytose unter der Lupe
Der Entstehung von Blutkrebs auf der Spur
Eine Störung der Blutbildung – eine B-Zell-Lymphozytose – führt in einigen Fällen zu Blutkrebs. Doch die epigenetische Signaturen beider Erkrankungen gleichen sich und bilden sich sehr früh. Dies zeigte nun ein internationales Team mit Hilfe von Proben von Betroffenen.
Chronische Leukämien beginnen häufig schleichend. Erst nach und nach breiten sich weiße Blutzellen oder ihre Vorläufer unkontrolliert im Knochenmark aus, beeinträchtigen dort die normale Blutbildung und wandern in Milz, Leber und andere Organe ein. Vom häufigsten Typ Blutkrebs bei Erwachsenen, der chronischen lymphatischen Leukämie (CLL), ist die Vorstufe bekannt: die monoklonale B-Zell-Lymphozytose (MBL). Fast jeder Fall einer CLL-Leukämie geht auf eine solche Lymphozytose zurück.
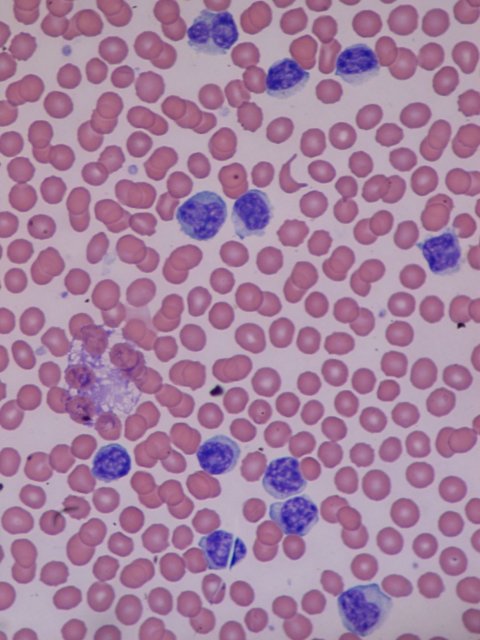
Bildquelle: Bobjgalindo, Lymphocytosis, CC BY-SA 4.0
Doch obwohl sich bei einer Lymphozytose weiße B-Zellen übermäßig teilen, gilt sie nicht als Krebserkrankung und wird entsprechend auch nicht behandelt. Umgekehrt bekommen jedoch pro Jahr nur ein bis zwei Prozent der Lymphozytose-Patienten auch eine Leukämie. Wie unterscheiden sich also beide Erkrankungen und wie hängen sie zusammen?
Dieser Frage ging ein Forschungsteam um Alexander Meissner vom Max-Planck-Institut für molekulare Genetik (MPIMG) in Berlin und Catherine J. Wu vom Dana-Farber Cancer Institute in den Vereinigten Staaten nach. Wie die Forschenden im Fachblatt Blood Cancer Discovery darlegen, ist eine für Krebs charakteristische chemische Signatur der DNA schon in den frühesten Stadien der Lymphozytose vorhanden. Die Veränderungen am Erbgut bleiben über den gesamten Zeitraum stabil und sogar nach einer erfolgreichen Krebstherapie weiter bestehen. „Es scheint, als würden die Weichen für die Krebserkrankung bereits äußerst früh gestellt werden“, sagt Alexander Meissner. „Die charakteristischen chemischen Veränderungen an der DNA könnten also eine Voraussetzung für die Entstehung der Krebserkrankung sein“, spekuliert der Forscher.
Für die Therapie hat dies aber keine unmittelbaren Konsequenzen: „Es wird auch weiterhin keinen Grund geben, eine monoklonale B-Zell-Lymphozytose mit klassischen Therapien zu behandeln“, sagt Catherine Wu. „Die Therapie bringt in diesem Stadium mehr Gefahren mit sich als die Erkrankung selbst. Allerdings könnten unsere Erkenntnisse einmal in neuartige Therapien einfließen.“
Möglicherweise gibt es bei anderen Krebsarten Vorläuferzellen mit veränderter Methylierung, die ganz normal wachsen und daher nicht auffallen
Helene Kretzmer
Die chemische Signatur, die die Forschenden untersuchten, besteht aus kleinen Molekül-Clustern („Methylgruppen“), die durch Enzyme direkt an die DNA-Doppelhelix angekoppelt werden. Die eigentliche Erbinformation bleibt dabei unberührt. Die Zelle ignoriert methylierte Abschnitte der DNA und liest die Erbinformation dort nicht ab. „Bei Krebszellen ist dieser epigenetische Leseschutz jedoch durcheinander geraten und damit der Zugriff auf die Informationen“, erklärt Helene Kretzmer, Erstautorin der Studie.
Um den Verlauf der Erkrankung auf der Ebene der Methylierungsveränderungen von Anfang bis Ende nachvollziehen zu können, nutzte das Team Proben von 23 Betroffenen mit Lymphozytose, von denen fünf später eine Leukämie entwickelten. Zudem konnten sie die Zellen von 25 an Leukämie erkrankten Personen vor und nach der Therapie charakterisieren. Die Zellen wurden einzeln analysiert und der Methylierungszustand erhoben. „Wir stellten zuerst fest, dass die Methylierungsmuster in jedem Stadium der Erkrankung auftreten und stabil bleiben“, sagt Kretzmer. „Damit war klar, dass sie den Krankheitsverlauf nicht direkt beeinflussen und wir wollten herausfinden, wann die Muster entstehen und ob sie ein Treiber der Erkrankung sein könnten.“
Die Erkenntnis, dass die Erbgutveränderungen tatsächlich so früh in der Krankheitsentwicklung auftreten, wirft neue Fragen für die Krebsforschung auf, sagt die Forscherin. „Möglicherweise gibt es bei anderen Krebsarten Vorläuferzellen mit veränderter Methylierung, die ganz normal wachsen und daher nicht auffallen.“ Diese Zellen befänden sich demnach an der Schwelle zu einem Krankheitszustand und wären anfälliger für eine Deregulation. „Bei der DNA-Methylierung handelt es sich um einen Abwehrmechanismus“, sagt Kretzmer. Denn Gene, die nur im Notfall abgelesen werden, tragen in der Regel keine Methylierung. Wenn diese Gene durch Krebs methyliert werden, kann die Zelle diese wichtigen Rettungsgene nicht mehr aktivieren. „Der Schutzmechanismus wird ausgehebelt“, sagt die Forscherin. „Umgekehrt erhält die Zelle durch Demethylierung Zugriff auf geschützte Bereiche, wodurch zum Beispiel Programme für die Zellteilung oder das Wachstum aktiviert werden und außer Kontrolle geraten können.“
Quelle: Max-Planck-Institut für molekulare Genetik
22.01.2021