© Daniel Peter / UKW
News • Weiterentwickelte CRISPR-Methode
Auf dem Weg zur Immuntherapie 2.0
Im Rahmen des Emmy Noether-Programms der Deutschen Forschungsgemeinschaft (DFG) baut Dr. Karl Petri am Universitätsklinikum Würzburg (UKW) eine Arbeitsgruppe auf, um neuartige CRISPR 2.0-Werkzeuge zur Generierung und Verbesserung von krebsgerichteten CAR-T-Zellprodukten zu entwickeln.
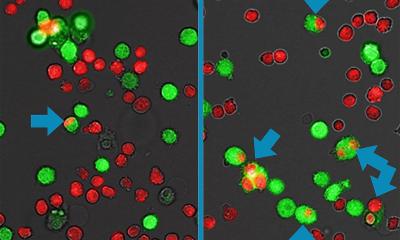
CAR-T-Zellen sind hocheffektiv in der Behandlung bestimmter Blutkrebsarten. Jedoch bestehen weiterhin Herausforderungen dieser neuen Therapieform, die erstmals 2017 in den USA und ein Jahr später in Europa für die Behandlung der akuten lymphoblastischen Leukämie (ALL) zugelassen wurde. Bislang gibt es zum Beispiel noch keine effektiven CAR-T-Zelltherapie für solide Tumoren. Weiterhin sind CAR-T-induzierte Remissionen nicht immer dauerhaft, und die CAR-T-Zell-Produktion ist langsam und aufwendig. Das möchte der Mediziner Dr. Karl Petri vom Universitätsklinikum Würzburg (UKW) ändern, indem er mit einer weiterentwickelten CRISPR-Methode die Immunzelltherapien für onkologische Erkrankungen noch effizienter, aber auch sicherer macht. Die Deutsche Forschungsgemeinschaft (DFG) unterstützt sein Forschungsvorhaben im Rahmen des Emmy Noether-Programms in den kommenden sechs Jahren mit knapp zwei Millionen Euro.
Unser Ziel ist es, das Einsatzgebiet von CAR-T-Zelltherapien zu erweitern und ihre Wirksamkeit zu verbessern, so dass zum Beispiel auch solide Tumoren mit CAR-T-Zellen effektiv behandelt werden können
Karl Petri
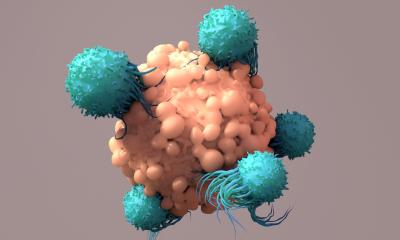
Prime-CAR Inspection heißt sein Projekt. Prime steht für die CRISPR 2.0-Methode CRISPR Prime Editing, die den gezielten und programmierbaren Einbau von DNA-Veränderungen in die therapeutischen T-Zellen ermöglicht; CAR für den chimären Antigenrezeptor, mit dem die körpereigenen T-Zellen der Patientinnen und Patienten ausgestattet werden und der den Immunzellen hilft, charakteristische Oberflächenmoleküle von Krebszellen zu erkennen und gezielt zu bekämpfen; Inspection für die Sicherheitvalidierung neuer Geneditierungsverfahren mit Hilfe modernster molekularer Diagnostik. „Während bei der herkömmlichen CRISPR-Cas9-Methode ein Doppelstrangbruch in das DNA-Molekül eingebracht wird, genügt bei der CRISPR Prime Editing-Methode ein Einzelstrangbruch, was präzisere Modifikationen der Zielzell DNA ermöglicht“, erklärt Karl Petri. Alle zwölf möglichen Basenpaar-Substitutionen sowie kleine Insertionen und Deletionen können mit CRISPR Prime Editing präzise in das T Zell Genom eingebracht werden. „Wenn man CRISPR-Cas9 als DNA-Schere bezeichnet, mit der man selektiv Genfunktionen ausschalten kann, dann ist Prime Editing vergleichbar mit Radiergummi und Bleistift, mit denen man DNA gezielt umschreiben kann.“
Neben der Optimierung der Geneditierungstechniken soll im Rahmen von Prime-CAR Inspection auch die Validierung der Sicherheit neuer Geneditierungstechniken standardisiert werden, damit eine klinische Translation möglich wird und am Ende leistungsfähigere CAR-T-Zellprodukte für Patienten mit Multiplem Myelom und anderen Krebserkrankungen zur Verfügung stehen.
„Bisher ist die CAR-T-Zelltherapie für einzelne Blutkrebsarten zugelassen. Unser Ziel ist es, das Einsatzgebiet von CAR-T-Zelltherapien zu erweitern und ihre Wirksamkeit zu verbessern, so dass zum Beispiel auch solide Tumoren mit CAR-T-Zellen effektiv behandelt werden können. Außerdem wollen wir CAR-T-Zellen so verändern, dass sie längere und dauerhafte Remissionen erzielen “, sagt Karl Petri.
Auch allogene CAR-T-Zellen, also veränderte T-Zellen von gesunden Spenderinnen und Spendern, stehen im Fokus seiner Forschung. „Mit CRISPR 2.0-Editing können bestimmte Moleküle der CAR-T-Zellen so verändert werden, dass die fremden Zellen vom Immunsystem nicht abgestoßen werden. Auf diese Weise können große Mengen von CAR-T-Zellen mit breiter Anwendbarkeit auf Vorrat hergestellt werden was eine schnellere und kostengünstigere Anwendung von CAR-T-Therapien ermöglicht“, erläutert der gebürtige Frankfurter.
Derzeit müssen für die CAR-T-Zelltherapie die weißen Blutkörperchen aus dem Blut der Erkrankten mittels Leukapherese von den übrigen Blutbestandteilen getrennt werden. Die Zellen werden im Labor gentechnisch verändert und den Betroffenen als lebendes Medikament über eine etwa zehnminütige Infusion wieder zugeführt. Eine einzige „scharf gemachte“ T-Zelle kann auf diese Weise Hunderte von Tumorzellen vernichten. Im Idealfall bleiben die T-Zellen ein Leben lang im Körper und schalten versteckte oder neu entstandene Tumorzellen aus.
Quelle: Universitätsklinikum Würzburg; Text: Kirstin Linkamp
05.08.2024