© Dr. Kateryna Maksymenko / Max-Planck-Institut für Biologie Tübingen
News • Typ-1-Zytokinrezeptoren im Visier
Mit Protein-Design zu neuen Leukämie-Therapien
Eine neue Strategie zur Entwicklung von Proteinantagonisten zeigt vielversprechende Ergebnisse bei der Bekämpfung von Leukämie, indem sie wichtige Rezeptoren ins Visier nimmt, um die Vermehrung von Krebszellen zu stoppen.
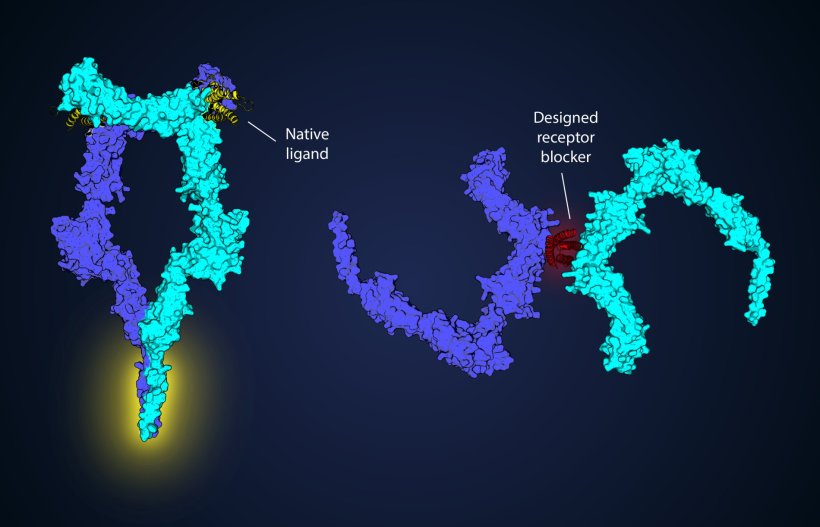
Ein bedeutender Fortschritt für die Krebsforschung: Einem Team von Wissenschaftlern des Max-Planck-Instituts für Biologie in Tübingen, des Universitätsklinikums Tübingen und der Universität Osnabrück ist es gelungen, proteinbasierte Antagonisten zu entwickeln, die selektiv den G-CSFR-Rezeptor blockieren, der mit der Entstehung mehrerer Blutkrebsarten, darunter die akute myeloische Leukämie, in Verbindung gebracht wird. Diese innovative Methode gibt Patienten und ihren Familien neue Hoffnung, indem sie die Wirksamkeit von Krebstherapien erhöht und mögliche Nebenwirkungen reduziert.
Die Wissenschaftler veröffentlichten ihre Erkenntnisse im Fachjournal PLoS Biology.
Eine gesunde Immunantwort hängt von der Bildung und Funktion weißer Blutkörperchen ab, die hauptsächlich durch den G-CSFR reguliert werden. Andererseits kann eine Überaktivität dieses Rezeptors zu einer unkontrollierten Zellproliferation und zur Entstehung von Krebs führen. Die mangelnde Spezifität vieler aktueller Medikamente führt zu systemischen Nebenwirkungen, die die Lebensqualität eines Patienten erheblich beeinträchtigen können. Um dieses Problem zu lösen, bieten die kürzlich entwickelten Antagonisten eine gezielte Methode zur Blockierung der G-CSFR-Signalübertragung.
„Besonders interessant ist die Empfindlichkeit der Rezeptoraktivität gegenüber seiner Assoziationsgeometrie, wobei die Steuerung der Geometrie ein Spektrum von Signalergebnissen erschließen kann“, erklärte Dr. Mohammad ElGamacy, leitender Forscher und Forschungsgruppenleiter am Universitätsklinikum Tübingen.
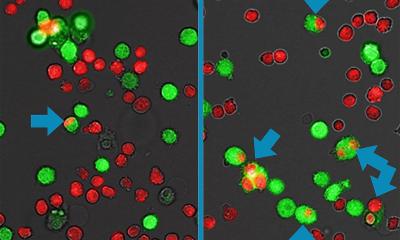
Um stabile, hochaffine G-CSFR-Antagonisten zu erzeugen, die den nativen Liganden übertreffen, verwendete das Forschungsteam ein de novo entworfenes Proteingrundgerüst, um bivalente Bindeproteine zu erzeugen. Die daraus resultierenden Designs binden den Rezeptor fester und verhindern seine Dimerisierung in eine Signalkonfiguration in Zellmembranen. Diese Vorgehensweise ermöglicht es den Antagonisten, den Rezeptor effizient zu blockieren und eine verbesserte thermische und proteolytische Stabilität zu erreichen, was sie für den therapeutischen Einsatz qualifiziert. Die Ergebnisse zeigten das Potenzial dieser Antagonisten als neue Klasse gezielter Therapeutika, indem sie zeigten, dass sie das Wachstum von Leukämiezellen in Laborumgebungen drastisch senken konnten.
Die Bedeutung dieser Entdeckung geht über die Leukämiebehandlung hinaus. Die entwickelten Antagonisten könnten auch bei anderen Erkrankungen eingesetzt werden, die durch eine Fehlregulation von G-CSFR gekennzeichnet sind, darunter verschiedene Autoimmun- und Entzündungskrankheiten. Das Forschungsteam konzentriert sich auf die Durchführung weiterer präklinischer Studien, um die Sicherheit und Wirksamkeit dieser Antagonisten in vivo zu bewerten und in Kürze klinische Studien durchzuführen.
Zusammenfassend lässt sich sagen, dass diese bahnbrechende Arbeit einen bedeutenden Schritt nach vorne bei der Suche nach wirksameren und gezielteren Krebstherapien darstellt. Durch die Nutzung der Möglichkeiten des Protein-Designs ebnen Forscher den Weg für innovative Behandlungen, die die Ergebnisse für Patienten, die an Leukämie und anderen verwandten Krankheiten leiden, verbessern könnten. Das Potenzial, die Medizin auf der Grundlage individueller Patientenprofile zu personalisieren, unterstreicht die Bedeutung dieser Forschung weiter, da sie darauf abzielt, maßgeschneiderte Lösungen für die einzigartigen Herausforderungen zu bieten, die diese komplexen Erkrankungen mit sich bringen.
Quelle: Max-Planck-Institut für Biologie
07.01.2025