News • Krebsforschung
Dem Urspung mutierter Zellen auf der Spur
Wie entwickeln sich die unterschiedlichen Zelltypen des Immunsystems? Auf welchem Weg bilden sich aus Stammzellen ausdifferenzierte Zelltypen wie zum Beispiel natürliche Killerzellen oder T-Zellen? Dabei sind viele Details unklar – doch wäre dieses Wissen wichtig, um etwa zu verstehen, an welcher Stelle bestimmte Krebsarten entstehen und wie sie sich gezielt behandeln lassen.

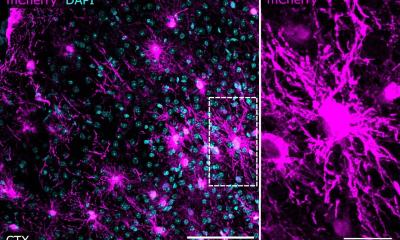
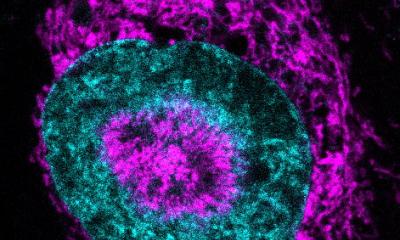
Foto: Universität Bielefeld/M.-D. Müller
Ein Forschungsteam hat jetzt ProSolo vorgestellt – eine Methode, mit der sich Entwicklungsprozesse auf Basis der DNA einzelner Zellen zurückverfolgen lassen. Die Studie dazu ist in Nature Communications erschienen. Die Studienautoren kommen von der Universität Bielefeld, der Universität Duisburg-Essen, dem Universitätsklinikum Essen, dem Helmholtz-Zentrum für Infektionsforschung in Braunschweig, dem Universitätsklinikum Düsseldorf und dem Centrum Wiskunde en Informatica in Amsterdam, Niederlande.
Ist eigentlich in jeder Zelle eines Menschen identisches Erbmaterial enthalten? Das könnte man annehmen. „Es stimmt aber nicht“, sagt Professor Dr. Alexander Schönhuth von der Technischen Fakultät der Universität Bielefeld, der die neue Studie gemeinsam mit Professorin Dr. Alice McHardy vom Helmholtz-Zentrum für Infektionsforschung in Braunschweig betreut hat. Die Zellen im menschlichen Körper teilen sich laufend – und bei jeder Teilung können Fehler auftreten. Derartige Mutationen führen dazu, dass das Erbmaterial einer Zelle sich von dem anderer Zellen unterscheidet. Teilt diese Zelle sich nun ihrerseits, gibt sie das veränderte Erbmaterial weiter – und womöglich passieren bei Teilungen der Tochterzellen weitere Fehler, die sich ebenfalls fortschreiben.
Solche Veränderungen sind oftmals harmlos, können aber aus zwei Gründen wichtig sein. „Zum einen können wir daran erkennen, welche Zellen voneinander abstammen“, sagt Schönhuth. „Zum anderen können solche Fehler die Ursache für verschiedene Krankheitsbilder sein.“ Ein klassisches Beispiel dafür sind Krebserkrankungen. Dabei sind typischerweise Gene von Veränderungen betroffen, die das Zellwachstum regulieren, sodass Zellen sich unkontrolliert vermehren und schließlich ein Tumor entsteht.
Zu wissen, wie Zellen voneinander abstammen, kann hilfreich sein, um die Entstehung von Krebs besser zu verstehen – etwa bei Leukämie, also Krebserkrankungen der Blutzellen. Im Fall von Leukämie verändern sich die Blutzellen beispielsweise im Knochenmark und vermehren sich unkontrolliert. „Wir wissen, was bei einer Leukämie passiert, aber wir wissen nicht, an welcher Stelle die Krankheit genau ihren Ursprung hat“, sagt Schönhuth. Wenn geklärt werden könnte, wie sich die Zellen ausdifferenzieren und an welcher Stelle typischerweise Mutationen entstehen, die zu Krebs führen, hätte das einen großen Einfluss auf Früherkennung und Behandlung.

Foto: Till Hartmann
Nun gibt es verschiedene Methoden, um DNA aus Zellen zu analysieren – doch bislang ist keine geeignet, um solche Untersuchungen mit einer hohen Genauigkeit durchzuführen. „Letztlich gibt es dafür zwei Möglichkeiten“, sagt der Doktorand David Lähnemann von der Universität Duisburg-Essen. Er ist Erstautor der Studie. „Der eine Weg ist, eine Probe mit sehr vielen Zellen zu verwenden und sie gesammelt auszuwerten. Die Alternative ist, eine geringe Zahl von Zellen sehr genau zu analysieren.“ Beide Methoden haben ihre Vor- und Nachteile. Bei einer Probe mit sehr vielen Zellen wird die DNA gesammelt extrahiert und analysiert. Seltene Mutationen bleiben dabei leicht unbemerkt und die Zellen lassen sich nicht in Beziehung zueinander setzen. „Nimmt man aber Einzelzellen für die Analyse, ist die Chance gering, genau dabei eine seltene Mutation zu erwischen“, erläutert Lähnemann.
Bei der Einzelzellen-Variante muss zudem die DNA vervielfacht werden. Dabei kann es zu Fehlern kommen, die eine Mutation vorgaukeln, während es sich in Wirklichkeit um einen Fehler beim Kopieren der DNA handelt. „Zudem wird die DNA beider Chromosomen nicht gleich schnell abgelesen“, sagt der Wissenschaftler. Dadurch kann es passieren, dass ein Großteil der DNA in der Probe am Ende nur von einem Chromosom stammt – und eine entscheidende Mutation auf dem anderen Chromosom dadurch womöglich nicht erkannt wird.
Um in den Daten so viele Mutationen wie möglich verlässlich zu finden, hat das Team die Methode ProSolo entwickelt. Das Verfahren zeichnet sich dadurch aus, dass es Proben von Einzelzellen gemeinsam mit einer Sammelprobe analysiert. Dabei werden statistische Verzerrungen und Fehler berücksichtigt und herausgerechnet. „So können wir besser bewerten, ob es sich beispielsweise um eine tatsächliche Mutation in der Einzelzelle oder um einen Kopierfehler der DNA bei der Vervielfachung handelt“, sagt Lähnemann. ProSolo steht als Open-Source-Software zur Verfügung (GitHub), auf deren Code jeder Zugriff hat, sodass alle, die möchten, sie anwenden oder auch bearbeiten können.
„Für alle Methoden in diesem Bereich sind sehr viele Rechenschritte notwendig“, sagt der Bioinformatiker. „Bei der bisher besten Methode mussten diese Schritte alle nacheinander ausgeführt werden. Mit ProSolo können wir jetzt so viele Rechenschritte parallel ausführen, wie wir Prozessoren in einem Rechner zur Verfügung haben. So können wir, was sonst Wochen dauert, auf wenige Tage verkürzen und auch große Datenmengen schnell auswerten.“
Mit der Entwicklung der Methode und der Software ist die Kooperation der Wissenschaftler noch nicht abgeschlossen: Nun geht es konkret darum, die Entstehung der Zellen des menschlichen Immunsystems zu untersuchen und besser zu verstehen. „Wir hoffen, dass wir damit einen Beitrag zur Krebsforschung und natürlich auch zur Behandlung leisten können“, sagt David Lähnemann.
Quelle: Universität Bielefeld
25.12.2021