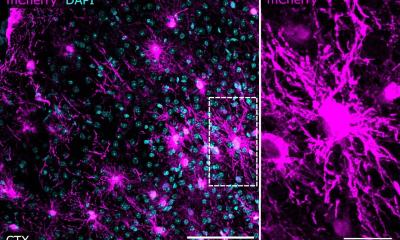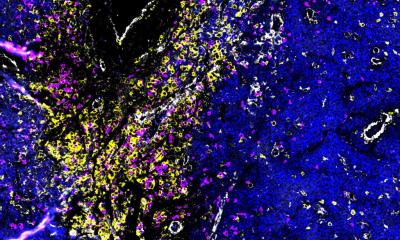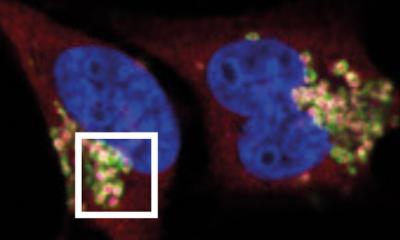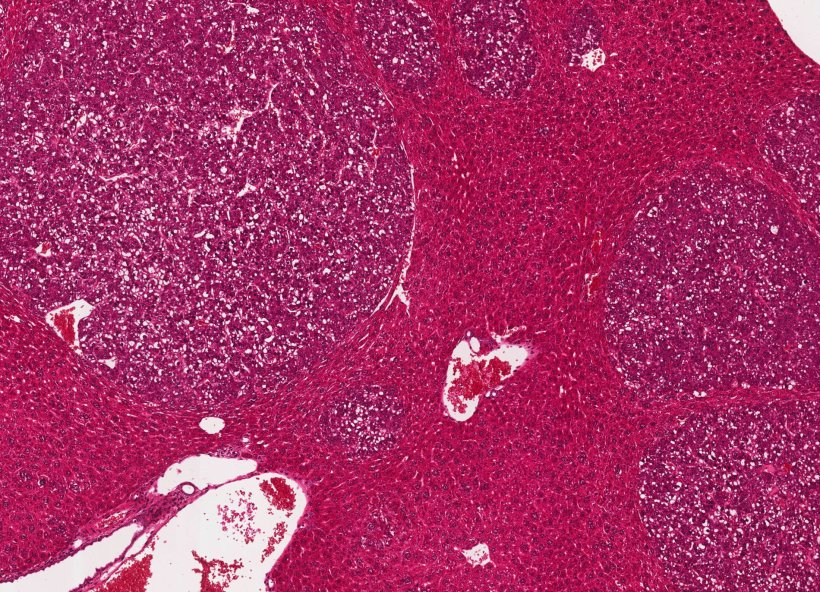
Bildquelle: Fabian Finkelmeier, Universitätsklinikum Frankfurt
News • Eisentod-Forschung
Ferroptose als Schlüssel für neuartige Kombinationstherapien gegen Krebs
Der Eisentod (Ferroptose) ist eine Form des gesteuerten Zellsterbens, mit dem der Körper kranke, defekte oder überflüssige Zellen abtötet. Dieser Prozess lässt sich nutzen, um die Wirkung einer Immuntherapie gegen Leberkrebs zu verstärken.
Dies haben jetzt Forschende des Georg-Speyer-Hauses, des Universitätsklinikums Frankfurt und der Goethe-Universität Frankfurt bei Mäusen zeigen können, die an Leberkrebs erkrankt waren. Die Kombinationstherapie wirkte auch gegen Darmkrebsmetastasen, die sich in der Leber angesiedelt hatten. Die Wissenschaftler veröffentlichten ihre Erkenntnisse im BMJ-Journal Gut.
Vor zehn Jahren wurde eine neue Form des gesteuerten Zelltods entdeckt, der Eisentod, wissenschaftlich: Ferroptose. Anders als bei einer schon lange bekannten Form des programmierten Zelltods, der Apoptose, nimmt die Zelle bei der Ferroptose größere Mengen an Eisen auf. Das Eisen wird in der Zelle verstoffwechselt und führt schließlich zur Zerstörung der Zellmembranen. Solchen Formen des Zelltods sind wichtige Steuerungselemente des Körpers etwa bei Entwicklungsprozessen und der Eliminierung defekter oder entarteter Zellen.
Offenbar ist die Kombinationstherapie von der Mikroumgebung der Leber abhängig und hängt nicht vom Ursprung des Krebses ab. Dies deutet darauf hin, dass unsere Kombinationstherapie bei Lebermetastasen jeder Krebsart wirksam sein könnte
Fabian Finkelmeier,
Zur Bekämpfung von Krebs haben sich seit einigen Jahren Immuntherapien als Behandlungsoption etabliert, bei denen das körpereigene Abwehrsystem dazu stimuliert wird, gegen Krebszellen vorzugehen. Eine Reihe dieser Immuntherapien setzt dabei erfolgreich an Schlüsselstellen des Immunsystems an, sogenannten Checkpoints, an denen das Immunsystem ausgebremst wird.
Immun-Checkpoints sind eine Art „Aus-Schalter“ an der Oberfläche tumorbekämpfender Immunzellen, so genannter T-Zellen, mit denen sich deren Aktivität herunterregulieren lässt. Bedient wird dieser „Aus-Schalter“ durch bestimmten „Schlüssel-“Proteine. Viele Tumoren bilden solche „Schlüssel“-Proteine, um sich vor Angriffen durch die T-Zellen zu schützen. Daher sind bei einigen Krebsarten medikamentöse Blockaden des „Aus-Schalters“, also Immun-Checkpoint-Blockaden, inzwischen Teil der Standardtherapie. Bei anderen Krebsarten wie zum Beispiel Leberkrebs ist das Ansprechen auf die Immun-Checkpoint-Blockade leider gering. Die Frankfurter Forschenden haben jetzt an Mäusen, die an Darmkrebs erkrankt waren, beobachtet, dass eine Substanz zur Auslösung der Ferroptose zur Aktivierung bestimmter Immunzellen (T-Zellen) führt. Solche T-Zellen können Krebszellen gezielt töten.
Das Problem: Die Aktivität der T-Zellen wurde durch zwei unabhängige Mechanismen sofort wieder gestoppt: Zum einen bildeten die Krebszellen ein „Schlüssel“-Protein zur Bedienung des „Aus-Schalters“ von T-Zellen (den Immun-Checkpoint-Rezeptor PD-L1). Zum andern traten weitere Zellen des Immunsystems auf den Plan, deren Aufgabe es ebenfalls ist, eine Immunantwort des Körpers zu bremsen, sogenannte Myeloide Suppressor-Zellen. Verabreichten die Forschenden den erkrankten Mäusen jedoch eine Dreierkombination aus einem Ferroptose-Aktivator, einem Immun-Checkpoint-Blocker und einer Substanz, die verhindert, dass Myeloide Suppressorzellen angelockt werden, so wurde das Wachstum der Lebertumoren deutlich reduziert.
In weiteren Tests an Mäusen stellen die Wissenschaftler fest, dass die Kombinationstherapie auch die Zahl Lebermetastasen reduzieren konnte, die von einem streuenden Darmtumor stammten. Der Darmtumor selber sprach allerdings nicht auf die Kombinationstherapie an. Prof. Fabian Finkelmeier, einer der beiden Erstautoren der Studie, sagt: „Offenbar ist die Kombinationstherapie von der Mikroumgebung der Leber abhängig und hängt nicht vom Ursprung des Krebses ab. Dies deutet darauf hin, dass unsere Kombinationstherapie bei Lebermetastasen jeder Krebsart wirksam sein könnte."
Dr. Claire Conche, die zweite Erstautorin, erklärt: “Mit dieser neuen Kombinationstherapie greifen wir das Immunsystem von drei Seiten an. Zunächst machen wir die tumorbekämpfenden T-Zellen reaktiv gegenüber den Tumorzellen. Dann beseitigen wir die Hindernisse, denen die tumorbekämpfenden T-Zellen gegenüberstehen: die Suppressionszellen und die Abschirmung durch PD-L1.“
Prof. Florian Greten, Direktor des Georg-Speyer-Hauses und Sprecher des LOEWE-Zentrums Frankfurt Cancer Institute, sagt: “Die Studie unterstreicht die entscheidende Rolle des Tumormikromilieus in der Krebstherapie. Wir haben uns hier auf das Immunkompartiment des Tumormikromilieus fokussiert und darauf, wie man das Immunsystem in Richtung einer starken Anti-Tumor-Antwort modulieren kann. Unsere Daten in präklinischen Modellen sind ermutigend für die Verbesserung der Immuntherapie-Optionen für Betroffene mit hepatozellulärem Karzinom und Lebermetastasen."
Quelle: Goethe-Universität Frankfurt
19.02.2023