Angewandte Chemie
Auf dem Weg zum künstlichen Muskel
In unseren Muskeln findet eine kollektive Bewegung „biomolekularer Motoren“ statt, um die makroskopische Bewegung zu erzeugen. Diesen Vorgang nachzuahmen, ist schon lange ein Ziel für Wissenschaft und Technik. Französische Wissenschaftler sind diese Ziel nun ein gutes Stück näher gekommen. In der Zeitschrift Angewandte Chemie stellen sie einen Ansatz für einen künstlichen Muskel vor, der auf einer hierarchischen Selbstorganisation supramolekularer muskelartiger Fasern basiert. Auf diese Weise konnten sie eine molekulare Bewegung bis auf die mikroskopische Skala verstärken.
Unser Muskelgewebe ist hierarchisch aufgebaut: Die kleinste funktionelle Einheit der Muskelfasern sind sogenannte Sarkomere. Diese sind aus dem Aktin-Filament und dem Myosin-Filament zusammengesetzt. Das Myosin ist ähnlich gebaut wie ein Bündel winziger Golfschläger, deren „Köpfe“ in die dünneren Aktin-Filamente hineinragen. Eine koordinierte Bewegung Tausender dieser Köpfchen sorgt dafür, dass die Myosin-Fasern entlang der Aktin-Filamente gleiten – das Sarkomer kontrahiert. Eine Vielzahl solcher Sarkomer-Einheiten ist longitudinal zu Myofibrillen verbunden, die wiederum lateral zu Fasern gebündelt vorliegen.
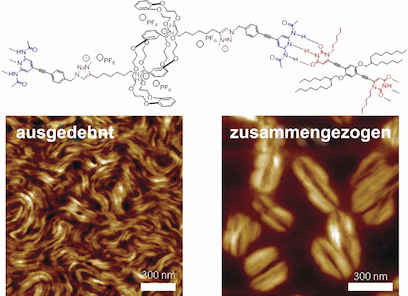
Das Team von der Universität Straßburg und der Universität Paris Diderot um Nicolas Giuseppone hat dieses Bauprinzip jetzt nachgeahmt. Als Baueinheiten dienen Rotaxane, bewegliche Molekülsysteme aus einem stabförmigen Molekül, auf das ein großer molekularer Ring „aufgefädelt“ ist. Aus Rotaxanen lassen sich Dimere bilden, wenn ein Ring fest an ein Ende des Stabes gebunden ist. Innerhalb des Dimers ist dann jeweils der Ring des einen Moleküls auf den Stab des anderen aufgefädelt. Solche Systeme wurden bereits als Basis für molekulare Schalter verwendet, denn durch eine Verschiebung der Ringe gegeneinander auf den Achsen sind sie zu teleskopartigen Kontraktionen und Extensionen in der Lage.
Die Forscher konstruierten ihre Rotaxan-Dimere so, dass es für die Ringe jeweils zwei „Einrastpositionen“ auf den Achsen gibt, in denen sie über Anziehungskräfte zu bestimmten Atomgruppen der Achse fixiert werden können. Durch einen Wechsel zwischen saurem und basischem Milieu kann kontrolliert zwischen den beiden Positionen hin und her geschaltet – und damit die Länge des Dimers variiert werden. Erstmals gelang es den Wissenschaftlern nun, Tausende dieser Dimere zu einigen Mikrometer langen supramolekularen Fasern zu verknüpfen. Dazu verwendeten sie Verbindungsstücke, die jeweils an spezielle Bindestellen an den Enden der Dimere haften – über mehrfache Wasserstoff-Brückenbindungen analog der Basenpaarung in der DNA-Doppelhelix. Die Verbindungsstücke ziehen sich zudem untereinander an (über π–π Stapelung und van der Waals-Kräfte) und sorgen so dafür, dass die einzelnen Fasern zu 10 bis 20 nm dicken Faserbündeln aggregieren. Elektronenmikroskopische Aufnahmen zeigen, dass sich diese im kontrahierten Zustand wie ein angespannter Muskel verdicken und im gedehnten Zustand eine längliche Form einnehmen.
Quelle: Gesellschaft Deutscher Chemiker e.V.
05.01.2016