Molekulare Störenfriede
Wie Proteine Kommunikation zwischen Bakterien verhindern
Schleimig sind sie, doch für Mikroorganismen eine geradezu gemütliche Umgebung: Biofilme. Vor äußeren Einflüssen geschützt, können Bakterien dort ungestört wachsen und Krankheiten auslösen. Wissenschaftlerinnen der Christian-Albrechts-Universität zu Kiel (CAU) erforschen, wie bereits die Entstehung von Biofilmen verhindert werden kann. Darauf basierend könnten Alternativen zu Antibiotika entwickelt werden, gegen die viele Krankheitserreger häufig bereits resistent sind. Die Studie zeigt, dass Strategien aus der Natur besonders wirksam sind, um Biofilme zu unterbinden.
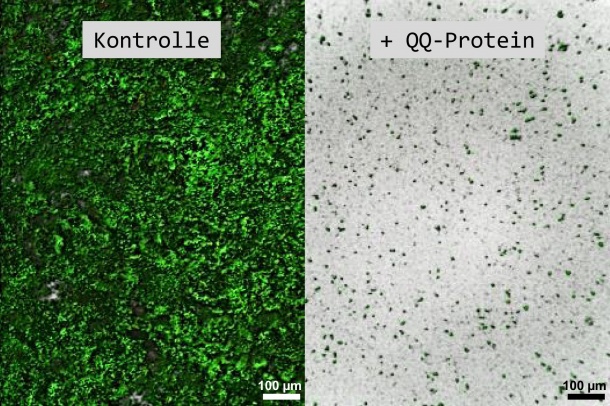

Um sich auf Oberflächen zu Zellansammlungen zusammen zu lagern, müssen Bakterien über Signalmoleküle (sogenannte „Autoinducer“) miteinander kommunizieren. Wird diese Kommunikation unterbrochen, kann sich kein Biofilm bilden. Diese Zell-Zell-Kommunikation, das sogenannte „Quorum sensing“ (QS), kann durch störend eingreifende Biomoleküle („Quorum quenching“-Proteine, QQ) beeinflusst werden. „Proteine können diese Signalmoleküle abbauen oder so modifizieren, dass sie nicht mehr funktionsfähig sind“, erklärt Schmitz-Streit. Ziel der vom Bundesministerium für Bildung und Forschung (BMBF) geförderten Studie war es deshalb, QQ-Proteine zu finden, die diese Kommunikation zwischen Bakterien möglichst wirksam stören.
Im Gegensatz zu bisherigen Forschungen konzentrierten sich Professorin Ruth Schmitz-Streit und Dr. Nancy Weiland-Bräuer, ebenfalls CAU, bei ihrer Suche auf natürliche Umgebungen außerhalb des Labors. „Denn Prinzipien, die in der Natur vorkommen, haben sich evolutionär über einen langen Zeitraum entwickelt und durchgesetzt. Dadurch sind sie besonders wirkungsvoll“, so Schmitz-Streit. Das zeigte das Forschungsteam mit einem metagenomischen Ansatz: Sie entnahmen Proben aus Meerwasser, aus Gletschern, aber auch von Quallen oder aus Biofilmrückständen in einer Waschmaschine. Daraus extrahierten sie die Gesamt-DNA und suchten davon ausgehend Proteine mit der Fähigkeit, Signalmoleküle abzubauen oder unwirksam zu machen.
Schmitz-Streit und Weiland-Bräuer stellten dabei fest, dass die Anzahl von QQ-Proteinen, die eine Zell-Zell-Kommunikation verhindern können, in den untersuchten marinen Umwelt-Proben tatsächlich enorm hoch ist – höher als bei terrestrischen Proben. „Das marine System rund um Meer, Wasser oder Algen ist als das älteste Ökosystem besonders reichhaltig an neuen, noch unentdeckten Substanzen. Hierin steckt ein großes Potenzial von biologischen Aktivitäten und QQ-Mechanismen“, so Schmitz-Streit.
Die Forschungsgruppe fand noch mehr: Das kommunikationsstörende Protein QQ-2 zeigte sich in den Untersuchungen als besonders wirksam. „Dieses Protein ist sehr robust und kann viele verschiedene Biofilme verhindern“, erklärt Weiland-Bräuer. Frühere Studien konzentrierten sich eher darauf, eine bestimmte Sprache von Bakterien zu stören. „Das QQ-2-Protein ist dagegen auf eine ‚Universalsprache‘ ausgerichtet und kann die Kommunikation von verschiedenen Bakterien stören. Es ist also ein ‚genereller Störenfried‘.“
Diese Grundlagenforschung liefert wichtige Erkenntnisse für eine mögliche biotechnologische und medizinische Anwendung in der Zukunft. Kann die Kommunikation von pathogenen Bakterien bewusst gestört werden, hindert das die Bakterien daran, in Biofilmen zu wachsen und Krankheiten auszulösen. Angesichts der steigenden Antibiotikaresistenz von Krankheitserregern könnte die hohe Wirksamkeit von natürlichen QQ-Mechanismen ein wirkungsvoller Ansatz in der Entwicklung von Medikamenten sein.
Originalpublikation:
Weiland-Bräuer, N., Kisch, M., Pinnow, N., Liese, A., Schmitz, R.A.: „Highly effective inhibition of biofilm formation by the first 1 metagenome-derived AI-2 quenching enzyme.” Frontiers in Microbiology, 13 July 2016. DOI: 10.3389/fmicb.2016.01098; http://journal.frontiersin.org/article/10.3389/fmicb.2016.01098/full
Quelle: Christian-Albrechts-Universität zu Kiel
01.08.2016