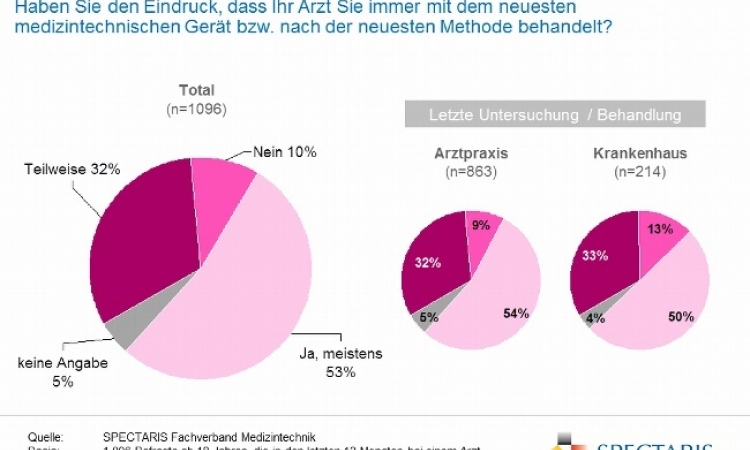
GKV-Versorgungsstärkungsgesetz: Bundesregierung greift Forderung auf
Anlässlich der Beratungen des Deutschen Bundestages zum GKV-Versorgungsstärkungsgesetz begrüßt Marcus Kuhlmann, Leiter des Fachverbandes Medizintechnik im Industrieverband SPECTARIS, dass die Bundesregierung der SPECTARIS-Forderung nach einer Regelung mit Augenmaß bei der geplanten Einführung einer Nutzenbewertung für neue Untersuchungs- und Behandlungsmethoden (NUB) unter der Verwendung von Medizinprodukten hoher Risikoklassen zumindest teilweise gefolgt ist.

"Die Bundesregierung scheint noch rechtzeitig erkannt zu haben, dass die ursprünglich geforderte Einführung einer umfassenden Nutzenbewertung von Medizintechnologien, bei denen Medizinprodukte der Risikoklassen IIb und III zum Einsatz kommen, zu weitreichend gewesen wäre. Noch im Referentenentwurf des jetzt als Gesetzentwurf vorliegenden GKV-Versorgungsstärkungsgesetzes wurden die Medizinprodukte der Klasse IIb und III nicht weiter differenziert. Diese Undifferenziertheit bei der Betrachtung von Medizinprodukten hätte Innovationen in der größtenteils mittelständisch geprägten Medizintechnikindustrie massiv gehemmt und verzögert. Die Patienten hätten damit künftig weniger schnell von moderner und sicherer Medizintechnik profitiert. Schließlich wäre das politisch bewusst gewollte Prinzip der "Erlaubnis mit Verbotsvorbehalt" in den Krankenhäusern aufgeweicht worden."
All dies ist zwar auch jetzt nicht gänzlich auszuschließen, immerhin wurde aber der Umfang von Nutzenbewertungen deutlich eingeschränkt. Mit dem vorliegenden Gesetzentwurf beschränken sich Nutzenbewertungen jetzt auf NUBs unter Verwendung von Medizinprodukten hoher Risikoklassen, die zusätzlich einen besonders invasiven Charakter aufweisen müssen oder den aktiven implantierbaren Medizinprodukten zuzurechnen sind. Aus Sicht von SPECTARIS wäre es auch angemessen, zusätzlich das Kriterium der Dauer, die ein Medizinprodukt im Körper verweilt, aufzunehmen. Zu begrüßen ist aber, dass Schrittinnovationen – kleine Produktverbesserungen – explizit nicht mehr, wie ursprünglich vorgesehen, erfasst sind, sondern ausschließlich Sprunginnovationen.
Leicht konkretisiert wurde im Gesetz auch die Formulierung zum Verständnis eines "neuen wissenschaftlich-theoretischen Konzepts". Hierunter fällt eine Methode, die "sich in ihrem Wirkprinzip oder ihrer Anwendbarkeit von anderen, in der stationären Versorgung bereits eingeführten systematischen Herangehensweisen wesentlich unterscheidet". Eine exakte Definition wird das Bundesgesundheitsministerium (BMG) im Rahmen einer Rechtsverordnung bis Ende dieses Jahres genauso nachliefern wie eine Definition dessen, was genau unter einem "besonders invasiver Charakter" zu verstehen ist. "Diesbezüglich hätten wir uns allerdings schon gewünscht, dass der Gesetzgeber dies bereits im Gesetz selbst regelt oder zumindest enge Vorgaben für die Präzisierung der späteren Verordnung durch das BMG festschreibt", so Kuhlmann weiter.
Nicht durchsetzen konnte sich die Industrie mit ihrer Forderung, den Hersteller eines Medizinproduktes aktiv in ein derartiges Bewertungsverfahren einzubeziehen. Nur der Hersteller verfügt über die notwendige Expertise zum jeweiligen Produkt und muss schließlich auch die Kosten für die an ein Bewertungsverfahren anschließende Erprobung übernehmen. Der Gesetzgeber will es jedoch dabei belassen, dass die Hersteller lediglich ein Recht auf Unterrichtung erhalten.
Zu bedauern ist zudem, dass der Gesetzgeber nicht dem von SPECTARIS vorgelegten Vorschlag eines zeitlich abgestuften Verfahrens gefolgt ist. Der Vorschlag sieht zunächst eine Vorabprüfung der Neuheit der Methode durch das Institut für Entgeltsystem im Krankenhaus (InEK) vor, bevor eine Methode durch den Gemeinsamen Bundesausschuss (G-BA) hinsichtlich ihres Nutzens bzw. Potenzials erprobt wird. "Mit diesem aus unserer Sicht pragmatischen Vorschlag hätte man unnötige Bürokratie vermeiden können, welche durch das Einreichen von Dossiers für Anträge beim G-BA entstehen und dann sowieso nicht vom InEK als positiv bewertet werden", so Kuhlmann.
Insgesamt kann die Industrie mit diesem Ergebnis sicher zufrieden sein, wenn man den Referentenentwurf vom November letzten Jahres im Vergleich betrachtet. "Erfreulicherweise konnte Schlimmeres verhindert werden. Man muss in diesem Zusammenhang auch immer sehen, dass es sich bei der im Rahmen des GKV-VSG neu eingeführten Nutzenbewertung primär um die Frage einer angemessenen (Kosten-)Erstattung durch die GKV geht und nicht, wie oft in öffentlichen und politischen Diskussionen suggeriert wird, um die unmittelbare Produkt- und damit auch Patientensicherheit. Diese müssen selbstverständlich auch gegeben sein, werden aber im Rahmen der CE-Zertifizierung geprüft und attestiert und sind somit nicht unmittelbarer Gegenstand des GKV-VSG", so Kuhlmann abschließend.
Quelle: SPECTARIS. Deutscher Industrieverband für optische, medizinische und mechatronische Technologien e.V.
12.06.2015