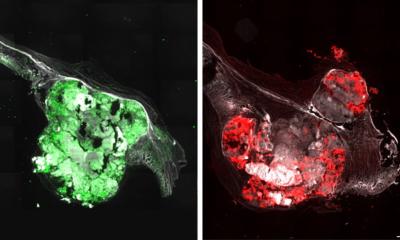
Bildquelle: umg/AG Ebert 2022
News • Herzinsuffizienz im Fokus
Potenzieller neuer Therapiesansatz für Herzmuskelschwäche entdeckt
Forscher aus dem Herzzentrum der Universitätsmedizin Göttingen (UMG) haben bei Patienten mit Herzmuskelschwäche einen defekten Eisentransportweg entdeckt, der sich negativ auf den Zellstoffwechsel auswirkt.
Zugleich fanden die Forschenden Wege, um diesen Defekt zu beheben und die normale Funktion der Herzmuskelzellen wiederherzustellen. Diese Erkenntnisse bieten mögliche Ansatzpunkte für neue Therapien. Die Ergebnisse sind veröffentlicht in der Fachzeitschrift „Circulation Research“.
Laut Angaben der Weltgesundheitsorganisation (WHO) leiden etwa 27% der Weltbevölkerung an einem starken Eisenmangel, der häufig auch zur Anämie führt. Bei einer Anämie ist die Anzahl der roten Blutkörperchen sehr niedrig, sodass das Blut nicht genügend Sauerstoff in den Körper transportieren kann. Patienten mit Eisenmangel leiden oft an Erschöpfung, Schwäche und Blässe bis hin zur Kurzatmigkeit und Brustschmerzen. Bei Patienten mit Herzschwäche (Herzinsuffizienz) verschlimmert Eisenmangel die Symptomatik und verschlechtert die Prognose. Etwa 50% der Herzinsuffizienz-Patienten haben wegen eines Defekts der Eisenaufnahme, -zirkulation und -ausscheidung im Darm einen Eisenmangel. Neben diesem Eisenaufnahmedefekt im Darm gibt es weitere Mechanismen, die für die Eisenaufnahme in einzelne Zellen sorgen. Diese waren in Herzmuskelzellen, auch Kardiomyozyten genannt, aber bislang weitgehend unverstanden.

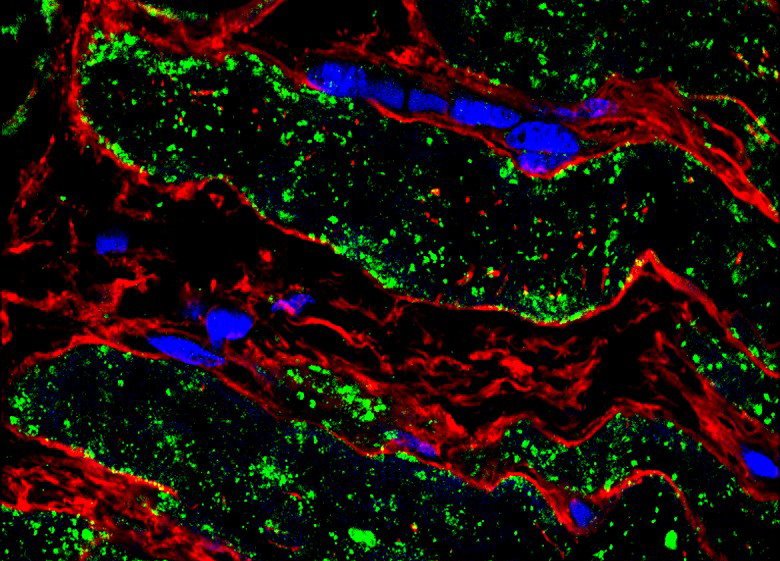
Bildquelle: umg/hzg
An dieser Stelle setzten die Göttinger Forscher um Priv.-Doz. Dr. Antje Ebert, Letztautorin der Studie und Gruppenleiterin der Arbeitsgruppe „Kardiovaskuläre Zellbiologie und Systemmedizin“ im Herzzentrum der Universitätsmedizin Göttingen (UMG) an. Die Wissenschaftler haben herausgefunden, dass Patienten mit einer krankhaften Erweiterung des Herzmuskels, einer dilatativen Kardiomyopathie, einen Eisenaufnahme-Defekt aufweisen. Dieser Defekt beeinflusst die Eisenaufnahme in die Herzmuskelzellen und dessen Verarbeitung sowie damit in Verbindung stehende Stoffwechselprozesse, zum Beispiel die Energieversorgung der Zellen. Zugleich konnte die Arbeitsgruppe zeigen, dass die Funktion dieses defekten Transportwegs auf drei verschiedene Arten wiederhergestellt werden kann: Durch die Gabe von zusätzlichem Eisen, einer speziellen molekularen Verbindung, die Transportweg „repariert“, oder mithilfe der Gen-Editierung (CRISPR-Cas), einem Verfahren zur gezielten Veränderung des Erbguts. Die neu gewonnenen Erkenntnisse sollen nun genutzt werden, um mögliche Therapieansätze für betroffene Patienten zu erforschen.
In Herzmuskelzellen ist der wichtigste Weg für die Eisenaufnahme die Clathrin-vermittelte Endozytose. Hierbei handelt es sich um einen Vorgang, bei dem essentielle Stoffe – in diesem Fall Eisen – in eine Zelle hineintransportiert werden. Zellen sind umgeben von einer dünnen Struktur, der Zellmembran. Diese grenzt den Zellinhalt von der Umgebung ab. Bei der Clathrin-vermittelten Endozytose stülpt sich die Zellmembran samt des zu transportierenden Eisens ins Innere der Zelle ein. Das Clathrin ist ein Protein, das sich im Inneren der Zelle an die eingestülpte Membran anlagert und für die Abschnürung von der Membran sorgt. Dabei entstehen „Bläschen“, auch Vesikel genannt, die das Eisen ins Innere der Zelle transportieren. Dieser Vorgang spielt eine zentrale Rolle bei der Aufnahme von Cholesterin, Hormonen, Transportproteinen, Antikörpern sowie auch Toxinen und Viren.

Foto: privat
„Um die Mechanismen der Eisenaufnahme in die Zellen besser zu verstehen, untersuchten wir im Labor Herzmuskelzellen, die aus Stammzellen gezüchtet wurden. Stammzellen sind Zellen, die in der Lage sind, sich auf besondere Art zu teilen und so Kopien von sich selbst sowie von anderen Zellen herzustellen. Sie wurden zuvor aus Blutproben von Patienten gewonnen, die an einer erblich bedingten Form der krankhaften Herzmuskelerweiterung, einer dilatativen Kardiomyopathie, leiden. Damit nutzen wir ein patientennahes Forschungsmodell. Die defekte Eisenaufnahme lässt sich nämlich auf bestimmte, die Krankheit verursachende Veränderungen im Erbgut, auch Mutationen genannt, zurückführen“, sagt Dr. Yuanyuan Dai, Erstautorin der Studie. „Erbliche, krankheitsverursachende Mutationen bieten die Möglichkeit, die molekularen Fehlfunktionen in Herzmuskelzellen von Patienten mit einer krankhaften Herzmuskelerweiterung zu verstehen. Darüber hinaus untersuchten wir Patientengewebe, das während Herzoperationen entnommen wurde. Es war wichtig, dass wir Teile des defekten Eisentransportwegs auch in Geweben von Patienten als Vergleich nachweisen konnten“, so Dr. Dai. Mithilfe einer hochsensitiven Massenspektrometrie-Methode untersuchten die Göttinger Herzforscher die krankhaft veränderten Herzmuskelzellen sowie das von Patienten mit dilatativer Kardiomyopathie stammende Herzgewebe. Anschließend ermittelten sie die vorliegenden Signalwege und Proteinfunktionen innerhalb dieser Zellen. Dabei identifizierten sie den Defekt der Clathrin-vermittelten Endozytose in den Zellen als einen zentralen Aspekt des neuen Krankheitsmechanismus. Dies traf sowohl in den im Labor-erzeugten Herzmuskelzellen als auch beim entnommenen Herzgewebe der Patienten zu.
Wir planen nun die weitere Untersuchung dieses Krankheitsmechanismus, der neue Therapieansätze für erwachsene Patienten mit erblich bedingter dilatativer Kardiomyopathie bereithält und zum Risikomanagement bei dieser Erkrankung beitragen könnte
Antje Ebert
„Die Korrektur des erblichen Defekts in den im Labor-hergestellten Herzmuskelzellen wurde mittels einer gezielten Veränderung des Erbguts durch Gen-Editierung (CRISPR/Cas) erreicht. Weiterhin konnte die Behandlung mit einem bestimmten Molekül, dem Rho-Aktivator II, oder die Gabe einer größeren Eisenmenge den Transportweg retten beziehungsweise die Clathrin-vermittelte Endozytose und die normale Funktion der Herzmuskelzellen wiederherstellen“, erklärt Priv.-Doz. Dr. Ebert. „Zusammen mit meinen Kollegen von der UMG, Prof. Ingo Kutschka, Direktor der Klinik für Herz-, Thorax- und Gefäßchirurgie, und Prof. Niels Voigt, stellvertretender Leiter des Instituts für Pharmakologie und Toxikologie, konnten wir dieses Ergebnis auch in einem weiteren wichtigen, patientenspezischen Modell bestätigen: In isolierten lebenden Herzmuskelzellen erwachsener Patienten konnten wir den defekten Transportweg ebenfalls nachweisen und durch Gabe der molekularen Verbindung Rho-Aktivator II seine Funktion verbessern. Wir planen nun die weitere Untersuchung dieses Krankheitsmechanismus, der neue Therapieansätze für erwachsene Patienten mit erblich bedingter dilatativer Kardiomyopathie bereithält und zum Risikomanagement bei dieser Erkrankung beitragen könnte“, so Priv.-Doz. Dr. Ebert weiter.
„Ich freue mich über die Publikation der Studie von Priv.-Doz. Dr. Antje Ebert, die mit ihren Kollegen eine wichtige Forschungsarbeit in Göttingen leistet. Mit den neuen Erkenntnissen über die Vorgänge der Eisenaufnahme in die Herzmuskelzellen und deren Fehlfunktionen bei einer dilatativen Kardiomyopathie können zukünftig neue Therapieansätze für Betroffene möglich werden“, sagt Prof. Dr. Gerd Hasenfuß, Direktor der Klinik für Kardiologie und Pneumologie und Vorsitzender des Herzzentrums der Universitätsmedizin Göttingen.
Quelle: Universitätsmedizin Göttingen
11.12.2023