MPI
Mit Kompassnadeln im Körper Echtzeitbilder erzeugen
Bildgebungsverfahren gibt es viele. Magnetic Particle Imaging (MPI) könnte einige von ihnen im Bereich der Echtzeitbildgebung jedoch bald in den Schatten stellen. Bei dem Verfahren werden magnetische Nanopartikel in den Körper injiziert und ihre Verteilung im Körpervolumen gemessen. Großes Potenzial hat das Verfahren in der kardiovaskulären Anwendung. Auf dem Deutschen Röntgenkongress 2015 sprach healthcare-in-europe.com mit Dr. Jörn Borgert, der die Federführung in der Entwicklung bei Philips Technologie GmbH inne hat.
Interview: Melanie Günther

Herr Dr. Borgert, wie funktioniert dieses neuartige Verfahren?
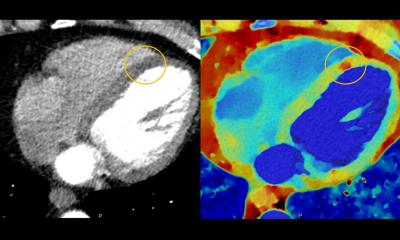
Borgert: Magnetic Particle Imaging (MPI) ist ein physikalisches Verfahren, mit dem man die lokale Konzentration von Eisenoxid-Nanopartikeln misst. Diese Eisenoxid-Nanopartikel sind in der medizinischen Bildgebung bereits aus der MRT bekannt. Der Tracer hat magnetische Eigenschaften. Er wird in die Blutbahn gespritzt und die Partikel zirkulieren durch den Körper. Dort wirken sie wie kleine Kompassnadeln. Mittels eines Magnetfeldes können diese Nadeln bewegt werden. Während sie sich bewegen, senden sie wiederum ein Signal zurück. Dieses spezifische Antwortverhalten wird durch Antennen erfasst und aus dieser Signalantwort wird die lokale Konzentration der Partikel berechnet. Das heißt, es kann genau nachgewiesen werden, an welcher Stelle im Körper wie viel von diesem Tracermaterial vorhanden ist. Die Partikel zirkulieren auch durch das Herz. Es ist also möglich Engstellen im Herzkranzgefäß zu erfassen, da die Blutmenge proportional zur Eisenoxid-Menge ist. Das sind die Visionen, die wir für das MPI im Kopf haben.
Was heißt in diesem Fall Vision?
Die Vision ist natürlich, dieses Verfahren irgendwann im klinischen Bereich anzuwenden. Die präklinische Forschung wurde im Zeitraum von 2005-2010 durchgeführt. Ein Gerät, das auf diesen Forschungsarbeiten beruht, wurde jetzt am UKE in Hamburg aufgestellt und ist als System auch kommerziell erhältlich. Mit diesem Gerät soll die translatorische Forschung durchgeführt werden. Sie ist für uns essenziell, denn parallel arbeiten wir an einem Ganzkörpersystem. Das heißt, an einem System, das eine Bohrungsgröße aufweist, die später auch eine klinische Anwendung ermöglichen würde. Dieses System am UKE ist jetzt sozusagen ein früher Spin-off, mit dem Anwender in der Klinik das Verfahren testen und verschiedene Anwendungsfelder durchspielen. Die Anwendungserfahrungen geben uns die klinischen Entwicklungsziele für das MPI vor.
Wo liegt der größte Vorteil gegenüber der MRT-Diagnostik?
Es ist immer ein bisschen schwierig, MPI mit dem MRT-Verfahren zu vergleichen. Der Vergleich liegt nahe, da bei MPI ebenso Magnetfelder zum Einsatz kommen. Im Grunde wird aber ein komplett anderer Effekt gemessen. Dadurch, dass ein Tracer zum Einsatz kommt, ist das Verfahren vergleichbar mit der Nuklearmedizin. Der Vorteil hier ist, dass MPI wesentlich schneller ist und außerdem dynamische Vorgänge abgebildet werden. Das ist speziell für die Herzdiagnostik wichtig, da sich das Herz bewegt und dort Schnelligkeit zählt. Andere Verfahren, bei denen eine hohe Dynamik oder ein hohes zeitliches Auflösungsvermögen Verfahren gefragt ist, sind natürlich auch denkbar.
Warum konzentrieren Sie sich am UKE in Hamburg im Moment auf die kardiovaskuläre Anwendung?
Wir können Instrumente wie Ballonkatheter oder Stents, die in der Herztherapie verwendet werden, ebenfalls mit Eisenoxid-Partikeln markieren und mittels MPI detektieren. Gerade in der kardiovaskulären Anwendung kommt es eben auf Geschwindigkeit an und das ist auch der Grund, warum wir uns dieses Anwendungsgebiet vorgenommen haben. Einerseits kann die Stärke von MPI effektiv genutzt werden und andererseits bietet sie einen großen Mehrwert für die Anwendung von kardiovaskulären Verfahren und somit für die Gesundheitsversorgung.
Können Sie sich auch eine Anwendung auf zellulärer Ebene vorstellen, sagen wir für die Detektion von Krebszellen?
Eisenoxid-Partikel werden bereits auf zellulärer Ebene in der MRT-Diagnostik angewendet. Allerdings ist die Detektion oft nicht sensitiv genug, die Partikel können also einfach nicht genau genug gemessen werden. Das liegt daran, dass die Partikel das MR-Signal verändern und dann ist sehr viel technischer Aufwand notwendig, um dieses Signal zu detektieren. Gegenüber der MRT ist das MPI-Verfahren, gerade was die Detektion von Eisenoxid-Partikeln angeht, viel sensitiver. Das kann man für die Markierung von Krebszellen, aber auch für Entzündungen oder Gewebeveränderungen im Körper nutzen. Es ist durchaus vorstellbar, auch sehr kleine Stoffmengen zu erkennen.
Wie verträglich ist der Tracer?
Im Prinzip ist es nichts anderes als ein Stoff, der bei Eisenmangel injiziert werden kann. Darin befindet sich partikuläres Eisenoxid , das sich in der Leber ansammelt. Der Körper bedient sich dann quasi in der Leber und nutzt das Eisen zum Beispiel für die Blutproduktion. Nach allem, was man weiß, wird der Tracer gut im Körper aufgenommen und auch wieder abgebaut.
Wie weit ist es noch bis zur klinischen Anwendung?
MPI ist eine interdisziplinäre Forschungsaufgabe. Wir sind auf einem guten Weg, zusammen mit den Anwendern das System zu optimieren. Wir arbeiten aber auch mit Partnern wie Bayer Healthcare und der Charité Berlin zusammen, die den Tracer weiter entwickeln. Dieser ist als Kontrastmittel keine Neuheit, ist aber auch optimierungsfähig, so dass er für MPI noch besser funktioniert. Auch aus diesem Grund wird es natürlich noch etwas dauern, bis MPI tatsächlich in der klinischen Anwendung ankommt.
PROFIL:
Dr. Jörn Borgert ist seit 2005 Senior Scientist und Leiter des Projekts Magnetic Particle Imaging (MPI) der Philips Technologie GmbH Innovative Technologies in Hamburg.
14.05.2015
- Bildgebung (1117)
- Kardiologie (520)
- Kardiovaskuläre Erkrankungen (331)
- MRT (623)
- Nanotechnologie (84)
- Radiologie (611)